Blærecancer er den fjerde hyppigste kreftformen blant menn i Norge etter prostata-, lunge- og coloncancer og den sjette hyppigste totalt. Sykdommen er ca. 3 ganger så hyppig blant menn som hos kvinner og forkommer sjelden før 50 års alder. Iflg. Krefregisteret var det 1263 ny tilfelle av cancer i ureter, blære og urethra i 2005, og majoriteten (anslagsvis 1150) var lokalisert til blære. Dette er en svært heterogen sykdom med variabel prognose. De fleste pasientene har gode langtidsutsikter, men krever likevel langvarig spesialistkontroll og en god del recidivbehandling. Faktisk lever i dag over 10000 pasienter med sykdommen, og nesten 3500 har hatt diagnosen i over 10 år. Et mindretall av svulstene har et mer aggresivt sykdomspotensiale med behov for en nokså inngripende og ressurskrevende primærbehandling. Internasjonale tall har vist at blærecancer faktisk er den mest kostbare kreftformen for samfunnet. Det foreligger nasjonale og europeiske retningslinjer for hånd-tering av denne sykdommen.

Etiologiske faktorer
Årsaken til blære kreft er i prinsippet carcinogener og co-carcinogener som utskilles i urinen og som påvirker et urotel med en cytogenetisk cancerdisposisjon. Røyking er den viktigste enkeltfaktoren vi kjenner til og øker risiko med 2-4 ganger. Hos 30-50% av pasientene er røyking en viktig utløsende faktor. Røykestopp nytter, selv om det går mange år før risikoen da er nede på gjennomsnittet. Yrkeseksponering i visse kjemiske og metallurgiske industrier har også vært i fokus. Verken alkohol eller kaffe synes å være risikofaktorer. Danske bryggeriarbeidere med et ølkonsum på 2-2,5 liter pr. dag viste ingen økt forekomst av blærecancer i forhold til en kontrollgruppe! Tidligere kjemoterapi og strålebehandling gir økt risiko, men betyr kvantitativt lite. Mht. arvelig disposisjon gir hereditær non-polypøs coloncancer (HNPCC) økt risiko for urotelcancer i nyrebekken og ureter, men merkelig nok ikke i blære.
Klassifikasjon
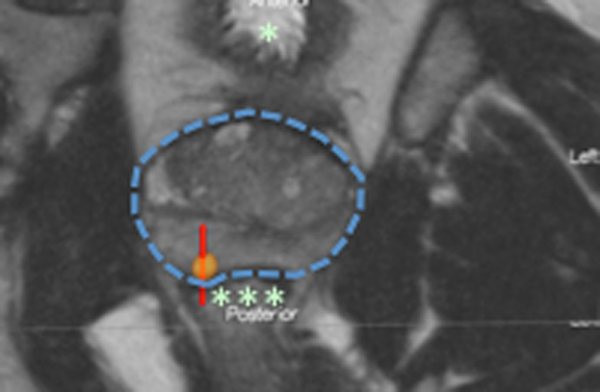
Som allerede nevnt, er blærecancer en svært heterogen kreftform, og behandlingen er helt avhengig av en klassifikasjon av sykdommen. Dette innebærer bestemmelse av særlig svulstens T-kategori (fig.1) og graden av cellulær atypi. WHO grad 1-3 har vært standardgradering i årtier, men et system med inndeling i bare lav- og høygradig malign tumor er på vei inn. Klassifikasjon er obligatorisk ved alle tilfelle av nyoppdaget blærecancer og er en av hensiktene med primærbehandlingen (se nedenfor). Det viktigste skillet i T-kategori går mellom T1 og T2 . Derav følger to hovedgrupper av svulster: Ikke-muskelinvasive og muskelinvasive svulster (tidligere kalt hhv. overfladiske og infiltrerende). Behandlingen av disse to hovedgruppene er helt forskjellig. Spesielt må også nevnes carcinoma in situ (Tis) som en potensielt farlig sykdom. Den kan forekomme alene eller sammen med eksofytisk tumor og kan virke uskyldig. Likevel kan den etter hvert infiltrere i dybden uten at den vokser som intraluminal tumor. Dermed kan den unnslippe ordinær endoskopisk diagnostikk da epitel med Tis ikke alltid visuelt skiller seg klart fra normalt urotel.


Bilde 2. Bildet til venstre viser cystoskopi i vanlig hvitt lys med en meget svakt synlig svulst øverst i bildet. Til høyre er samme område undersøkt med PDD. Den utydelige svulsten vises nå klart ved rød fluoresens, og i tillegg ser man en fluoreserende svulst nedenfor, som ikke var synlig i bildet til venstre.
Diagnostikk
De aller fleste blærecancerpasientene diagnostiseres som følge av en hematuriutredning. Ved makroskopisk hematuri finnes blærecancer hos 10-30% av pasientene, avhengig av om hematurien er ledsaget av symptomer eller ikke. Norsk Urologisk Cancer Gruppe har anbefalt 4 uker som maksi-mal ventetid for spesialistutredning av makrohematuri. Ved asymptomatisk mikrohematuri finnes blærecancer så sjelden (ca. 0,5%) at screening med stix ikke er anbefalt. Likevel kan rutineundersøkelse av urinen være indisert hos visse risikogrupper som storrøykere og enkelte personer i risikoyrker. Ca. 10% av pasientene diagnostiseres på annet grunnlag enn hematuri. Spesielt skal man tenke på blærecancer hos eldre kvinner med terapiresistente urinveisinfeksjoner, og disse har da gjerne en invasiv cancer. Generelt øker irritative symptomer fra de nedre urinveier risiko for at invasiv svulst foreligger.
Standardutredningen av hematuri har i mange år vært billeddiagnostikk med urografi og ultralyd nyrer etterfulgt av cystoskopi. Nå er imidlertid CT-urografi i ferd med å erstatte urografi/ultralyd i denne utredningen. Også cystoskopien endrer seg da fleksible skop har kommet som et alternativ til de stive skopene. Fordelene med de fleksible skopene er at pasientene kan undersøkes på en vanlig benk uten beinholdere. Undersøkelsen kan også være mindre ubehagelig for pasienten, særlig for menn, og tilgjengeligheten til vanskelige steder i blæren kan være bedre. Likevel medfører disse skopene høyere kostnader enn stive skop. Cystoskopifunnene må beskrives systematisk og standardisert da visse funn har både terapeutiske konsekvenser og prognostisk verdi. Det gjelder forhold som tumorstørrelse, lokalisasjon, multiplisitet, bredbaset/smalstilket, papillomatøs/solid. Urincytologi kan anvendes som et supplement ved usikre cystoskopifunn, men har dårlig sensitivitet for lavgradige svulster (ca. 30%) og bedre for høygradige svulster (ca. 60-70%). Derimot er spesifisiteten nær 100%. Ved pågående makrohematuri har cytologi ingen verdi. Det er også lansert ulike urintester, som påviser tumorrelaterte produkter i urin. Dette er bed-side-tester eller laboratorietester.Noen av disse har ganske høy sensitivitet (70-90%), men spesifisiteten er for lav til å kunne erstatte cystoskopiutredningen og cytologi eller anvendes i screening av risikogrupper. De kan muligens brukes i recidivoppfølgingen, alternerende med cystoskopikontroller.
En svakhet ved cystoskopi er at carcinoma in situ er vanskelig å se i et ordinært hvitt lys. Veldig små svulster er også lette å overse. Fotodynamisk diagnostikk (PD) er da til god hjelp. En substans (hexaminolevulinat) innstilleres i blæren før undersøkelsen og gir en akkumulering av porfyriner selektivt i urotelcancercellene. Når blæreveggen belyses med et blått lys, vil da svulstene fluoresere rødt som en kontrast til den blå bakgrunnsbelysningen av normalt urotel (fig.2). Fluoreserende områder kan da biopseres/reseseres. Dette gjør at man oppdager opptil 30% flere maligne lesjoner i blæren, og behandlingsstrategien kan endres hos opptil 20-30% av pasientene som følge av dette. Nytten er størst for påvisning av carcinoma in situ. Denne metoden er under innføring ved flere norske avdelinger og brukes foreløpig mest ved operasjonsavdelingene og ikke poliklinikkene da man vil ha mulighet til å biopsere/operere samtidig. Metoden krever investering i noe spesialutstyr, bla. optikker. Foreløpig brukes stive skop, men fleksible skop til dette bruk er under utprøving.
Initial behandling
Alle nyoppdagete blæresvulster, uavhengig av klinisk T-kategori, gjennomgår først den velkjente transurethrale reseksjonen (TURB). Inngrepet er terapeutisk for ikke-muskelinvasive svulster og bidrar til bestemmelse av T-kategori ved alle svulster ved at histopatologi beskriver evt. dybdevekst. I tillegg får vi gradering. Sammen med TURB hører bimanuell palpasjon av blæren som ledd i bestemmelse av klinisk T-kategori. Man vurderer om blæren er bevegelig eller fiksert, og dette har vist seg som mer nyttig enn CT/MR i operabilitetsvurderingen av selve blæren for radikaloperasjon. Etter denne primære prosedyren er da ikke-muskelinvasive svulster som regel ferdigbehandlet og går inn i et kontrollopplegg, mens muskelinvasive svulster må vurderes for radikalbehandling. Det er likevel unntak fra dette generelle opplegget.

Figur 3. Eksempel på utvidet lymfeknutedisseksjon til høyre i bekkenet. Fettvev inneholdende lymfoid vev er fjernet slik at arteria og vena iliaca communis, externa og interna er helt renset. Disseksjonen går her nesten opp til aortabifurkaturen.
Videre opplegg for ikke-muskelinvasive svulster
Denne svulstkategorien omfatter T-kategoriene Tis, Ta og T1 (fig.1) og utgjør 75-80% av nyoppdagede blæresvulster. Disse svulstene karakteriseres av en høy recidivtendens, men også en viss tendens til progresjon til muskelinvasiv sykdom. Ca. 70% av pasientene vil få en eller flere recidivepisoder. Ta- svulster med lav malignitetsgrad/WHO grad 1-2 recidiverer gjerne som samme type svulst, mens høygradig maligne/WHO grad 3 T1 svulster (T1G3) kan både recidivere og progrediere. Forhold som tumorstørrelse, multiplisitet og samtidig forkomst av Tis er forhold som øker recidivrisiko. Recidivrisiko varer i prinsippet livet ut, men for lavgradige Ta-svulster er den svært lav etter 5 år. Det foreligger egne tabeller for å estimere risiko både for recidiv og progresjon.
For å redusere risiko for recidiv er det i dag god dokumentasjon for å gi en enkeltinstillasjon av et cytostatikum intravesikalt innen 6-24 timer etter TURB. Urotelcancer har en tendens til imlantasjon, og hensikten med dette opplegget er å hindre tidlig recidiv som følge av at løsrevne tumorceller ved TURoperasjonen implanteres og gir ny tumor. Dette opplegget er vel nå innført ved de fleste avdelinger her i landet. Recidivrisiko de første 1-2 år blir da redusert med ca. 40%. Den langsiktige recidivrisiko og progresjonsrisiko påvirkes ikke av dette opplegget.
Etter den initiale TURB med postoperativ cytostatikainstillasjon vil pasienter med Tasvulster gå inn i et kontrollopplegg med cystoskopier med gradvis økende intervall hvis recidiv ikke påvises. For de fleste er dette opplegget livslangt. Små recidiv av åpenbart helt overfladiske tumores kan elektrokoaguleres eller laserkoaguleres poliklinisk/dagkirurgisk. Større recidiv må gjennomgå ny TURB. T1G3-svulster må gjennomgå en ny TURB ca. 6-8 uker etter den første TURB for å sikre at T1-stadiet virkelig er korrekt. I opptil 25% av tilfellene vil man da finne muskelifiltrasjon eller man kan enda hyppigere finne resttumor som fortsatt er T1. Først etter denne andre TURB vil videre opplegg bli bestemt.
Recidiv-/progresjonsprofylakse
For å redusere risiko for recidiv har man ved risikosvulster i mange år anvendt ulike regimer med instillasjonsbehandling i blæren. Felles for disse oppleggene er 6 ukentlige blæreinstillasjoner etterfulgt av mindre hyppige instillasjoner (vedlikeholdsbehandling) over en periode på 1-3 år. Behandlingen er poliklinisk, vanligvis som en sykepleierkonsultasjon, og aktuelle substans holdes i blæren min. 1 time. Hvis cystoskopikontrollene viser behandlingssvikt (recidiv), avbrytes vanligvis opplegget. Flere typer cytostatika er anvendt i slike opplegg, og responsraten for de beste har vært ca. 50-60% recidivfrihet i 3-5 år etter avsluttet behandling. Problemet er altså at effekten ikke er spesielt langvarig.
I dag er det BCG som er standardsubstans for slik instillasjonsbehandling. De levende svekkede tuberkelbacillene induserer en immunrespons i blære-veggens submucosa (aktiverer ”killer cells”), som hindrer carcinogenese. Responsraten ligger her på 70-80%, og vedlikeholdsbehandlingen gir en booster-effekt, som gir en langvarig virkning på recidivraten. Mer enn 10 års varighet er dokumentert. Ulempen med BCG er toksisitet. I eget materiale over 5 år var det 25% av pasientene som måtte avbryte opplegget som følge av bivirkninger, mens 25% avbrøt pga. recidiv eller progresjon. Av de som gjennomfører hele eller det meste av opplegget regner vi at ca. 70-80% har en tilfredsstillende effekt. Til forskjell fra kjemoterapi kan BCG ikke bare hindre recidiv, men også reduserere progresjonsrisiko. Ved lavgradige hyppig recidiverende Ta-svulster har BCG dårligere effekt. Hos disse pasientene og hos gamle pasienter, som naturlig nok ikke har behov for en spesielt langsiktig effekt, kan kjemoterapi med ford-el anvend-es primært. Kjemoterapi har bedre toler-abilitet enn BCG og kan til og med ha effekt hos pasienter der BCG svikter. Kjemoterapi har imidlertid dårlig effekt på carcinoma in situ.
De etablerte indikasjonene for slik instillasjonsbehandling er:
• Hyppig recidiverende Ta- svulster (3 tumorepisoder på < 18 måneder)
• Førstegangs T1G3-tumores
• Carcinoma in situ med en viss utbredelse

Figur 4. Kutan ureteroileostomi (”Bricker”) der ureteres sutureres til den kraniale delen av et ileumsegment og den kaudale enden legges ut som stomi. Merk at appendix er fjernet.
Spesielle vurderinger ved T1G3-svulster
Denne høygradig maligne svulsten som infiltrerer submukosa, står behandlingsmessig i en vanskelig mellomstilling. Selv om TURB etterfulgt av BCG-instillasjoner er standardbehandling og kan helbrede pasienten, har denne svulsten også et betydelig progresjonspotensiale. Bla. kan 10-15% av pasientene ha regionale lymfeknutemetastaser på diagnosetidspunktet. I dag er det blitt stadig vanligere å anbefale radikalbehandling (cystektomi) til denne undergruppen allerede primært og ikke bare hvis BCG-behandlingen svikter. De fleste urologer har opplevd at man her har vært for sent ute med radikalbehandling. Vi har foreløpig ikke molekylære markører som pålitelig nok kan skille ut ”killer-svulstene”, så vi må bruke mer kliniske parametre. Tumor lokalisert i blærehalsnivå, carcinoma in situ i tillegg til tumor, dyp infiltrasjon i submukosa med mikrovaskulær infiltrasjon og forholdsvis ung pasient er blant forhold som trekker i retning av tidlig radikalbehandling. Noe av de samme vurderingene gjelder også for pasienter med utbredt carcinoma in situ.
Videre opplegg for muskelinvasivesvulster – radikalbehandling
Mens de fleste ikke-muskelinvasive svulstene har en meget god prognose og sjelden tar livet av pasienten, er T2- T4 svulstene en mer aggressiv, dødelig sykdom. Denne svulstkategorien utgjør ca. 20% av nye blærecancere, og de aller fleste av disse viser seg som invasiv svulst primært. Bare 10-15% har først vært diagnostisert som overfladisk svulst, som senere har progrediert. Generelt er radikal cystektomi gullstandard ved behandling med kurativ intensjon av muskelinfiltrerende blærecancer. Selv om det kan være vanskelig å sammenligne, har en Cochrane-analyse, basert på eldre materialer, antydet en overlevelsegevinst av kirurgi fremfor strålebehandling. Ekstern strålebehandling anvendes derfor hos pasienter som enten ikke er egnet for radikaloperasjon eller ikke ønsker å gjennomgå et slikt inngrep. Annen blæresparende behandling som TUR + kjemoterapi eller stråler + segmental blærereseksjon er ikke godt nok dokumentert til å kunne anbefales som kurativ behandling.
Selv om både kirurgien og strålebehandlingen har forbedret seg mhp. morbiditet og mortalitet (gjelder kirurgien), har det praktisk talt ikke skjedd noen forbedring av den cancerspesifikke overlevelsen gjennom de siste tiår. Årsaken til dette er nok at ca. halvparten av pasientene med muskelinvasiv sykdom har mikrometatstaser på diagnosetidspunktet. For kirurgi ser neo-adjuvant kjemoterapi til å gi en gevinst på 5-8%, og burde nok vært mer fremme i lyset enn det er i dag. Nytten av adjuvant kjemoterapi er uavklart og skal evalueres i pågående studier. Totalt sett for denne gruppen ligger 5-årsoverlevelse på ca. 40-60% ved kirurgi. Det går bedre med pT1 og pT2 svulstene (65-75%) enn pT3 og pT4 svulstene (20-30%). Tallene ligger ca. 10-20% lavere for stråleterapi, men her går man ut fra det kliniske T-stadiet, så det ikke helt sammenlignbart. Der stråler ligger nærmest kirurgi synes å være ved de mindre avanserte svulstene (til og med T2).
Radikal cystektomi
Dette er et inngrep som innebærer ganske store omveltninger for pasienten. Han/ hun får et helt nytt urinsystem, som krever en omlegging av de daglige rutiner, og seksualfunksjonen går vanligvis tapt. Fra kirurgens side var tidligere inngrepet fryktet pga. faren for store peroperative blødninger og postoperative anastomoselekkasjer med høy mortalitet. Disse forhold er betydelig bedret, slik at perioperativ mortalitet i dag ligger på ca. 1-3%. For eksempel fikk nyere hemostaseteknikker i en prospektiv studie redusert transfusjonsbehovet fra 34% til 6% av pasientene sammenlignet med tradisjonell operasjonsteknikk. Forbedret operasjonsteknikk sammen med flere friskere eldre mennesker har bidratt til at vi nå opererer også pasienter over 80 år, og det er dokumentert at det ikke er noen forskjell i komplikasjonsfrekvens for pasienter over og under 75 år. Seleksjon av de eldste pasientene har nok også en betydning her.
En annen vesentlig endring over tid er synet på indikasjonsstilling. De etablerte indikasjonene har vært muskelinvasive svulster som er bevegelige (operable), T1G3 svulster (diskutert ovenfor), BCG-resistent carcinoma in situ og utbredt Ta-sykdom som ikke kan saneres ved transurethrale reseksjoner. Tidligere opererte man nesten bare med kurativ hensikt, men i dag gjøres også palliative cystektomier av lokalavanserte tumores, selv med noe lymfeknutemetastasering. Selv fikserte tumores hos de noe yngre pasientene i god allmenntilstand kan gjøres operable ved kjemoterapi. Begrunnelsen for denne palliasjonskirurgien er å befri pasienten for de betydelige lokale problemene slike svulster kan gi, selv om langtidsoverlevelse ikke oppnås.
Den preoperative utredning for kartlegging av sykdommen etter den initiale TURB er ikke veldig omfattende. For eksempel utredes skjelettet ikke for metastaser med mindre pasienten har suspekte symptomer. Undersøkelse av de øvre urinveier (CT urografi) er nødvendig med tanke på urinavledningen (hydronefrose/funksjonsløs nyre?) og for å se etter samtidig uroteltumor i øvre urinveier. Verken CT eller MR er gode nok til å utrede lymfeknutemetatstasering (falskt negativt resultat i 50-90%). Et viktig forhold er tidspunktet for operasjonen. Det har nok vært et problem at det for ofte har tatt lang tid fra diagnose til cystektomi har vært utført, noe som kan ha flere grunner (”doctors delay”, pasientvegring, 2nd. opinion, henvisning til annet sykehus for operasjon osv.). Det er nå dokumentert både bedre overlevelse og gjennomsnittlig lavere sykdomdstadium hos de som opereres innen 12 uker etter diagnostidspunktet, noe som dermed må tilstrebes.
Operasjonen omfatter selve cystektomien, lymfeknutedisseksjon i bekkenet og konstruksjon av et nytt urinsystem. Hos mannen fjernes urinblæren, prostata og sædblærene og en sjelden gang hele urethra, mens hos kvinnen fjernes genitalia interna inkludert fremre vaginalvegg i tillegg til blæren. Disse utvidede ekstirpasjonene gjøres en bloc og har både en onkologisk og en operasjonsteknisk begrunnelse. Anvendelse av rotikulerende staplinginstrumenter (endo-GIA) på de laterale karstrukturene (pediklene) og erfaring fra radikale prostatektomier med kontroll av vena dorsalis penis ved apex prostatae har gjort inngrepet mer kontrollert enn tidligere. Hos mannen er det av og til mulig å bevare ”potensnervene” på samme måte som ved radikal prostatektomi.
Lymfeknuteedisseksjon
Denne disseksjonen har tradisjonelt vært ekstirpasjon av lymfeknutene i fossa obturatoria på begge sider. Hvis frysesnitt viste metastaser, gikk man for mange år siden ikke videre med selve cystektomien. I dag anvendes frysesnitt lite, og selv makroskopiske metastaser fjernes. Lymfeknutedisseksjonen har gått fra å være ren staging til å kunne ha et terapeutisk potensiale. Prognosen synes bedre jo flere lymfeknuter som fjernes. For å fjerne flere lymfeknuter er det lansert ulike utvidede disseksjonsfelt fra iliacabifurkaturen og helt opp til arteria mesenterica inferior på aorta (fig.3). Dette er for tiden et aktuelt diskusjonstema internasjonalt. Det er ikke bare kirurgens disseksjon som er viktig, men også hvor nøye patologen leter etter lymfeknutene. Forholdene er ikke godt nok dokumentert til at utvidet disseksjon er tatt inn som obligatorisk i for eksempel de europeiske retningslinjene, selv om det gjøres ved stadig flere sentra.
Urinavledning
Hvis pasienten har overlevd sykdommen uten recidiv de første 2-3 år, er han sannsynligvis helbredet. På lang sikt er det derfor eventuelle problemer med urinavledningen som vil være i fokus. Ved cystektomi er det tre urinsystemer som er aktuelle: Kutan ureteroileostomi (”Bricker-avledning”), kontinent urostomi eller ortotopt blæresubstitutt. For en abdominalkirurg er det nyttig å vite at appendix alltid fjernes ved disse avledningene, slik at appendicitt er utelukket som senere diagnose. Standardmetoden er fortsatt Brickeravledning (fig.4). Denne er velprøvd og enkel og med gode langtidsresultater. I Sverige får ca. 80% av cystektomerte en slik avledning (2006). Selv ved sentra med stor entusiasme for de nyere metodene får opptil 50% en Brickeravledning. Kontinent urostomi var lenge alternativet til Bricker, men er i dag for en stor del erstattet av ortotopt blæresubstitutt. Kontinent urostomi er fortsatt aktuelt hvis urethra må fjernes samt hos kvinner da mange er tilbakeholdne med blæresubstitutt hos kvinner pga . større risiko både for inkontinens og retensjon (høres paradoksalt ut, men er det ikke). Det er lansert uttallige varianter av kontinent urostomi og blæresubstitutt og med anvendelse av ileum- og colonavsnitt eller begge deler (fig.5). Felles for alle metodene er at man må lage et lavtrykksreservoar ved å detubulere tarmen og konvertere den fra et rør til en sekk. I tillegg lages en antirefluksmekanisme for å beskytte de øvre urinveier, selv om det er diskutert hvor omfattende denne må være. Ved kontionent urostomi må det også lages en kontinensmekanisme, som kan kateteriseres av pasienten, mens man ved blæresubstitutt anastomoserer substituttet til det som er igjen av pasientens eget kontinensapparat etter at blære og prostata er fjernet.
Det er nokså åpenbart at disse alternativene til Bricker er mer kompliserte med potensiale for problemer. Selv om flertallet er fornøyd, er det pasienten selv, som etter informasjon, må velge metode da det er han som skal leve med systemet og som må vurdere hvilke mulige komplikasjoner han evt. kan leve med.




Figur 5. Eksempel på ortotopt blæresubstitutt (am. Studer). 55 cm ileum isoleres (a). 40 cm spatuleres og man begynner å lage substituttet (b). Ureteres syes inn kranialt på det ikke- detubulerte tarmstykket, som virker som en ”buffer” mot refluks. Substituttet fullføres og suturene for urethra-anastomosen legges (c). Substituttet er ført ned til bekkenbunnen og anastomosesuturene er knyttet (d).
Fremtidsperspektiver
Ved alle stadier av blærecancer, selv de ikke-invasive med særlig god prognose, er det behov for forbedringer. Det arbeides med molekylære markører. Det ideelle er at disse kan forutsi recidivrisiko, slik at kontrollintervallene kan tilpasses dette. Pålitelige urintester for recidivkontroll vil være ressurssparende. Viktigst er kanskje markører som kan forutsi progresjon av ikke-muskelinvasiv svulst til muskelinvasivitet. Det arbeides også med markør for å forutsi BCG-respons, men det er også ønskelig med mindre toksisk behandling enn BCG. Fotodynamisk behandling er under utprøving som et mulig supplement til BCG. Det er også helt nødvendig med mer effektiv behandling av muskelinvasiv sykdom. Her må det nok nye prinsipper til for å forbedre dagens radikalbehandling vesentlig. Radikalkirurgien står sannsynligvis på terskelen til en ny epoke da laparoskopisk og robotassistert cystektomi er publisert fra noen sentra.
Til slutt må vi også få bedre kunnskap om hvordan vi faktisk behandler pasientene her i landet og om dette er i tråd med retningslinjene. I Sverige har de et slikt kvaltetsregister, og det arbeides også for å få innført det samme hos oss gjennom Kreftregisteret.