Høygradige gliomer er en sjelden kreftform som oppstår i hjernen. Svulstene forekommer oftest hos voksne, men kan også ramme barn. De kjennetegnes av en heterogen biologi og en rask, diffus vekst som strekker seg utover marginene man ser på MR. Kirurgi utgjør hjørnestenen i den multimodale behandlingen, der prognosen avhenger av hvor mye tumorvev som kan fjernes uten å påføre pasienten varige og funksjonsnedsettende nevrologiske utfall.
Innledning
Gliomer er en heterogen gruppe av primære hjernesvulster som utgår fra gliaceller i sentralnervesystemet. De kan oppstå i alle deler av sentralnervesystemet, men forekommer hyppigst supratentorielt hos voksne. Gliomer er den vanligste formen for ondartet hjernesvulst hos voksne, men er samlet sett sjeldne og utgjør under 2 % av alle kreftformer (1).
Den nyeste klassifikasjonen av hjernesvulster deler gliomer inn basert på histopatologiske og molekylære kriterier (2). Over 30 undergrupper er nå definert, og molekylære markører som IDH-mutasjon, 1p/19q-kodelejson, ATRX-status og metylering av promoterregionen til MGMT har fått avgjørende betydning for klassifikasjon og prognose (2). Gliomer graderes etter Verdens Helseorganisasjons (WHO) inndeling fra grad 1 til 4. Grad 4 gliomer er de mest aggressive svulstene og er kjennetegnet av høy proliferasjonsrate, nekrose og mikrovaskulær proliferasjon (3). Høygradige gliomer WHO grad 4 inkluderer flere svulsttyper. De vanligste er glioblastom (IDH-villtype), astrocytom (IDH-mutert), og diffust midtlinjegliom (H3 K27-endret). Sistnevnte forekommer hyppigst hos barn (2). Disse svulstene kjennetegnes av hurtig vekst, diffus infiltrasjon og dårlig prognose, til tross for multimodal behandling med kirurgi, stråle- og kjemoterapi (4).

Tabell 1. Oversikt over de vanligste formene for gliomer. WHO grad 1 gliomer er skarpt avgrenset og oftest kurerbare med kirurgi alene. Man kan benytte betegnelsen lavgradig gliom om WHO grad 2-3 og høygradig gliom om WHO grad 3-4. Denne betegnelsen kan variere mellom kilder og vi omtaler her kirurgi for svulster med mistenkt WHO grad 4.
Glioblastom
Glioblastom er den vanligste formen for høygradig gliom og utgjør rundt 90 % av alle grad 4-gliomer hos voksne (Figur 1). Den aldersjusterte insidensen i Norge er 5,3 per 100 000 personår, med 251 nye tilfeller i 2024 (1). Median alder ved diagnose er 64 år, og sykdommen forekommer noe hyppigere hos menn. Standardbehandlingen har vært uendret siden 2005 og består av maksimal kirurgisk reseksjon, etterfulgt av konkomitant behandling med stråling og det alkylerende legemiddelet temozolomid, og deretter adjuvant temozolomid (5). For yngre pasienter som gjennomgår full behandling er median overlevelse 15 måneder med en toårs overlevelse på 27% (5). Norske populasjonsdata har bekreftet disse tallene, men viser at median overlevelse i en uselektert populasjon er rundt 12 måneder og toårs overlevelse 17% (6). Prognosen påvirkes av pasientens funksjonsstatus, alder, behandlingsintensitet og MGMT-metyleringsstatus, der sistnevnte indikerer respons på behandling med temozolomid (5,7). Siden introduksjonen av kjemoterapien temozolomid i 2005 er det ikke innført noen nye behandlingsmodaliteter. Likevel har overlevelsen gradvis bedret seg, der forbedringer i den kirurgiske behandlingen trolig har spilt en sentral rolle (6).
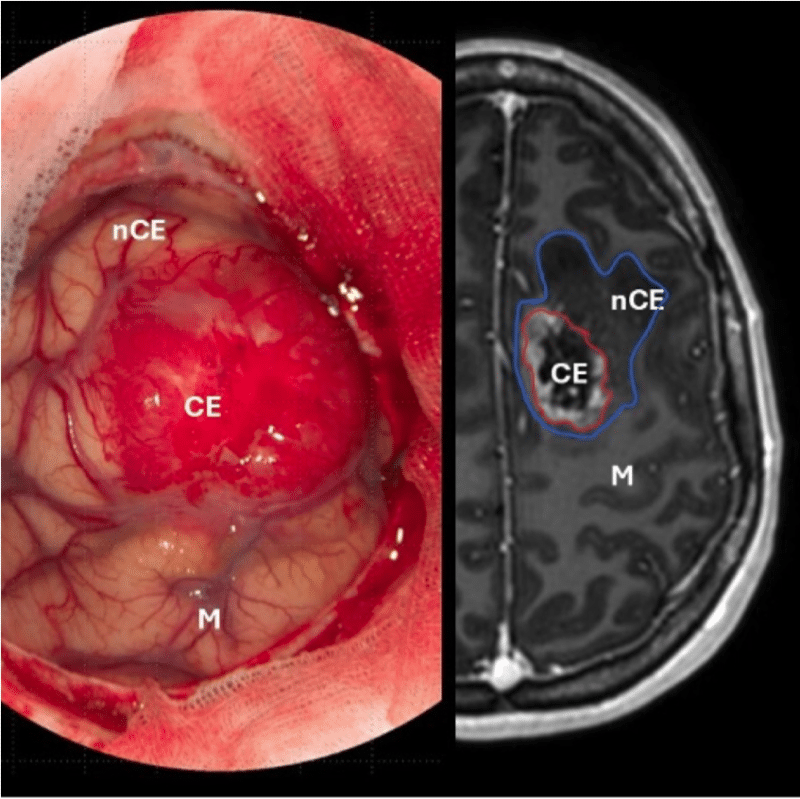
Figur 1. Til venstre: peroperativt bilde av malign og ekspansiv tumor med rik neovaskularisering. Til høyre: utdrag av MR (T1-serie med kontrast), som viser omfanget av tumor i hjernen. Kontrastladende del av tumor (CE) har vært det etablerte målet for reseksjon, men er nylig blitt erstattet med et mål om supramaksimal reseksjon som også omfatter ikke-kontrastladende tumor (nCE). Området for motorisk kontroll av høyre hånd er også markert (M).
Kirurgi ved glioblastom
Kirurgi er den første og viktigste behandlingsmodaliteten ved glioblastom. Det sikrer vev for histopatologisk og molekylær diagnose, lindrer symptomer, reduserer tumorbyrden og bidrar til lengre overlevelse. Målet er maksimal trygg reseksjon – å fjerne mest mulig tumorvev uten å påføre pasienten varig nevrologisk skade. En rekke studier har vist en klar sammenheng mellom grad av reseksjon og overlevelse (8,9,10), noe som også er vist i norske populasjonsdata (6). Data fra det norske kvalitetsregisteret fra 2019-2023 viser at 85 % av pasientene gjennomgikk reseksjon som primærbehandling, mens 15 % gjennomgikk en diagnostisk biopsi (11). Den postoperative 30-dagers mortaliteten var 1,5 % etter reseksjon (12).
Den moderne forståelsen av reseksjonsgrad er standardisert gjennom klassifikasjonen utarbeidet av RANO-resect (Response Assessment in Neuro-Oncology) (13). Klassifikasjonen baseres på postoperativ MR utført innen 72 timer etter kirurgi, og deler reseksjonen i fire klasser avhengig av gjenværende tumorbyrde:
- Klasse 1: Supramaksimal reseksjon – ingen kontrastladende resttumor + ≤5 cm³ ikke-kontrastladende tumor.
- Klasse 2: Maksimal reseksjon – ≤1 cm³ kontrastladende resttumor
- Klasse 3: Subtotal reseksjon – >1 cm³ kontrastladende resttumor
- Klasse 4: Diagnostisk biopsi
Klassifikasjonen er basert på retrospektive, multisenterdata fra 1008 pasienter med nydiagnostisert glioblastom. Pasienter der man oppnådde en klasse 1-reseksjon hadde en median overlevelse på 24 måneder sammenlignet med 19, 15 og 10 måneder i henholdsvis klasse 2-4 (Figur 2). Selv om en mer omfattende reseksjon er assosiert med lengre overlevelse, må inngrepet utføres med varsomhet. Nye, alvorlige nevrologiske utfall etter kirurgi medfører et betydelig prognosetap (4). Det er derfor avgjørende å balansere graden av reseksjon mot risikoen for varig nevrologisk skade, og å unngå alvorlige, permanente funksjonsutfall.
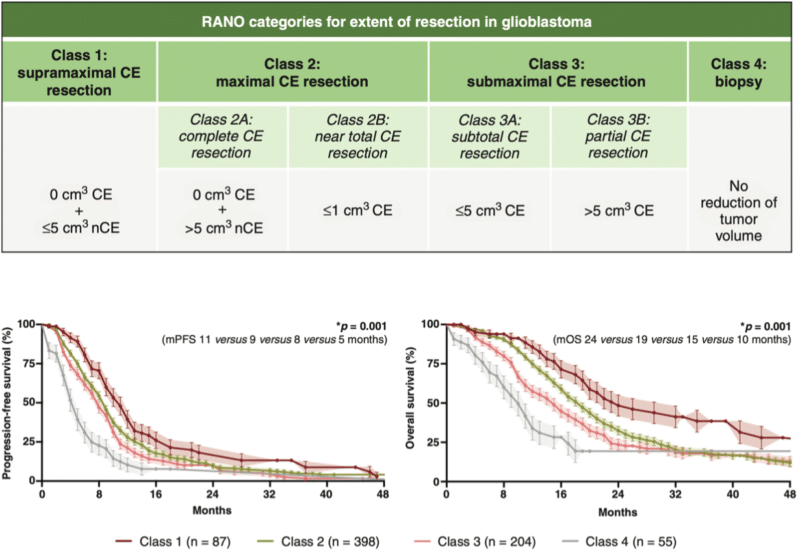
Figur 2. RANO-resect-gruppens klassifikasjon av postoperativ tumorbyrde etter kirurgi for glioblastom, inndelt i RANO-klasse 1-4. Figuren viser kurver for progresjonsfri overlevelse og total overlevelse med Kaplan-Meier analyse i de ulike reseksjonsklassene. Figuren er gjengitt uten endring fra Karschnia et al. (13) med tillatelse under Creative Commons Licence versjon 4.0 (https://creativecommons.org/licenses/by/4.0/). CE = contrast enhanced tumor , mPFS = median progression free surivival, mOS = median overall survival.
Kirurgiske hjelpemidler
Fluorescensstyrt kirurgi (5-ALA)
Et viktig fremskritt innen gliomkirurgi har vært introduksjonen av fluorescensbasert visualisering av tumorvev under reseksjon ved bruk av 5-aminolevulinsyre (5-ALA). Stoffet tas selektivt opp i tumorceller og omdannes intracellulært til fluorescerende porfyriner. På denne måten kan høygradig gliomvev i tumorens ytterkant lettere identifiseres ved et karakteristisk fargeomslag når det belyses med ultrafiolett lys (~400 nM), i kontrast til omkringliggende normalt hjernevev som ikke fluorescerer. I en randomisert fase 3-studie ble det vist at fluorescensveiledet kirurgi ga en signifikant høyere andel komplette reseksjoner (65% vs. 36%) og forbedret seksmåneders progresjonsfri overlevelse (41% vs. 21%) uten økt morbiditet (14). 5-ALA-assistert reseksjon er nå etablert som standardmetode ved de fleste nevrokirurgiske sentre både i Norge og internasjonalt.
Nevronavigasjon og intraoperativ bildeveiledning
Avanserte MR-protokoller med diffusjonsvektede bilder (DTI/CSD) anvendes for å fremstille viktige nervefiberbaner (f.eks. kortikospinale baner og fasciculus arcuatus) i hjernen og deres relasjon til tumor (Figur 3A-D). Moderne nevronavigasjon gjør det mulig å integrere preoperative MR-bilder i den kirurgiske planleggingen og følge instrumentene i sanntid under inngrepet. Dette gir økt orienteringsevne og presisjon, og bidrar til tryggere og mer målrettet reseksjon. Ved bruk av intraoperativ ultralyd kan resttumor identifiseres, og det kan korrigeres for anatomi som endres i forbindelse med inngrepet («brain shift»). Retrospektive studier har vist at intraoperativ ultralyd øker andelen totale reseksjoner uten å øke komplikasjonsraten (15). Intraoperativ MR muliggjør oppdatert avbildning underveis i operasjonen, men er ressurskrevende og foreløpig kun tilgjengelig ved enkelte universitetssykehus (16). Nyere data kan tyde på at bruk av intraoperativ MR øker andelen pasienter som oppnår supramaksimal reseksjon, og trolig også bedrer overlevelsen (17).
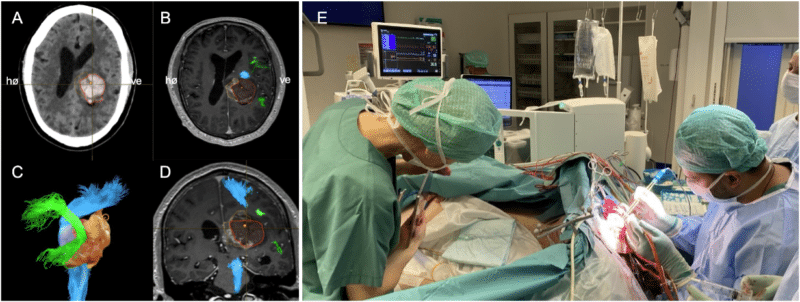
Figur 3. A) Preoperativt aksialt CT-bilde av tumor med blødning. B) Preoperativt aksialt MR-bilde (T1 med kontrast) som viser høygradig tumor (oransje sirkel) og blødning (rød sirkel) med nervefiberbaner fremstilt i relasjon til tumor; kortikospinale baner i blå og fasciculus arcuatus i grønn. C) Tredimensjonal fremstilling av tumor i relasjon til nerverfiberbaner (kortikospinale baner i blå og fasciculus arcuatus i grønn). D) Preoperativt koronalt MR-bilde (T1 med kontrast) som viser høygradig tumor (oransje sirkel) og blødning (rød sirkel) med nervefiberbaner fremstilt i relasjon til tumor; kortikospinale baner i blå og fasciculus arcuatus i grønn. E) Tett samarbeid mellom nevropsykolog (til venstre), kirurg (til høyre) og pasient (i midten) under våken testfase for å ivareta språkfunksjon under reseksjon av tumor. Pasienten har samtykket til at bilde publiseres.
Våken kraniotomi og funksjonskartlegging
Ved svulster lokalisert nær funksjonelt viktige (elokvente) områder, særlig de som er involvert i språk- eller motorisk funksjon, kan våken kraniotomi benyttes med direkte kortikal og subkortikal stimulering (Figur 3E). Denne tilnærmingen reduserer risikoen for permanente funksjonstap og muliggjør mer omfattende reseksjon (18). En retrospektiv, multisenterstudie med 1047 pasienter med glioblastom i elokvente områder, viste at våkenmonitorering var assosiert med lengre overlevelse, sannsynligvis fordi metoden reduserer risikoen for nye alvorlige nevrologiske utfall (19). Nevrofysiologisk monitorering muliggjør både sanntidsovervåkning og anatomisk kartlegging av funksjonelt viktige områder i grå og hvit substans, særlig relatert til motorisk funksjon (20). Ved å kombinere slike metoder med spesialiserte MR-sekvenser tatt preoperativt kan kirurgen lettere identifisere og bevare kritiske nervebaner under inngrepet (20).
Kirurgisk beslutningstaking
Målet ved kirurgi for glioblastom er maksimal trygg reseksjon. Enkelte pasienter er imidlertid ikke egnet for en slik strategi, enten på grunn av pasientrelaterte faktorer (alder, komorbiditet) eller tumorrelaterte forhold (beliggenhet i elokvente områder, multifokalitet). Hos disse pasientene kan biopsi være riktig tilnærming for å etablere diagnose og muliggjøre inkludering i kliniske studier. For biologisk eldre pasienter er nytteverdien av reseksjon omdiskutert. I en fransk, prospektiv, multisenterstudie (ANOCEF-trial) ble 107 pasienter over 70 år randomisert til biopsi eller kirurgisk reseksjon (22). Studien viste at reseksjon var trygt og førte til en lengre periode med bevart funksjon og livskvalitet, selv om man ikke kunne påvise at det ga lengre overlevelse. Den eksterne validiteten er imidlertid omdiskutert, ettersom studien hadde lav inklusjon av pasienter per senter (ni kirurgiske avdelinger over 12 år). Manglende rekruttering til kirurgiske randomiserte studier er en velkjent utfordring i feltet. En nyere retrospektiv, multisenterstudie viste at pasienter med høyt postoperativt funksjonsnivå kombinert med RANO-resect klasse 1 eller 2, kunne oppnå overlevelse som reduserte betydningen av høy alder som risikofaktor (23).
Indikasjon for reoperasjon ved gjenvekst av tumor er omdiskutert. Omtrent 1 av 10 pasienter med glioblastom gjennomgår en ny operasjon for tumorresidiv i Norge (12). I en retrospektiv studie av 681 pasienter med residiv av glioblastom ble det funnet at re-reseksjon var assosiert med en signifikant bedre overlevelse sammenlignet med ikke-kirurgisk behandling (median 11 vs. 7 måneder). Denne gevinsten ble imidlertid kun observert hos pasienter med ≤1 cm³ resttumor etter reoperasjon, mens supramaksimal reseksjon utover kontrastladende tumor ikke ga ytterligere overlevelsesfordel, men økt risiko for postoperative nevrologiske sekveler (24). Retrospektive studier på feltet er imidlertid beheftet med risiko for seleksjonsskjevhet av pasienter, og kirurgisk strategi må derfor individualiseres ut fra tumorens lokalisasjon, pasientens funksjonsnivå og forventet toleranse for videre behandling. Ved dype eller elokvent beliggende svulster bør kirurgen unngå skade på funksjonelt viktige områder, og her har teknikker som våken kraniotomi med kartlegging av språk og motorikk fått økende betydning (4). Hos pasienter med forventet kontrastladende resttumor eller multifokal sykdom bør man i stedet vurdere rebestråling, kjemoterapi eller palliativ tilnærming.
Oppsummering
Kirurgisk reseksjon utgjør førstelinjebehandlingen ved høygradige gliomer, og reseksjonsgrad er en viktig prognostisk faktor for pasientoverlevelse. De siste tiårene har teknologiske fremskritt, inkludert fluorescensveiledet kirurgi, nevronavigasjon, intraoperativ billeddiagnostikk og funksjonskartlegging, gjort det mulig å gjennomføre tryggere og mer komplette reseksjoner. Likevel gjør sykdommens diffuse og infiltrerende vekstmønster at ytterligere forbedring i pasientoverlevelse avhenger av fortsatt utvikling av effektive onkologiske behandlingsstrategier.
Referanser:
- Cancer Registry of Norway. Cancer in Norway 2025 – Cancer incidence, mortality, survival and prevalence in Norway. Oslo: Cancer Registry of Norway; 2025
- Louis DN, et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro-Oncology. 2021;23(8):1231–51.
- Skaga E, et al. Stable glioma incidence and increased patient survival over the past two decades in Norway: a nationwide registry-based cohort study. Acta Oncol 2024;63:83–94.
- Weller M, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2021;18(3):170–186.
- Stupp R, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987–996.
- Mendoza Mireles EE, et al. The benefit of complete resection of contrast enhancing tumor in glioblastoma patients: a population-based study. Neurooncol Pract. 2023;10(6):555–564.
- Hegi ME, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005;352:997–1003.
- Lacroix M, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg. 2001;95(2):190–198.
- Sanai N, Berger MS. Extent of resection influences outcomes for glioma patients. Neurosurgery. 2008;62(4):753–764.
- Molinaro A, et al. Association of Maximal Extent of Resection of Contrast-Enhanced and Non-Contrast-Enhanced Tumor With Survival Within Molecular Subgroups of Patients With Newly Diagnosed Glioblastoma. JAMA Oncol. 2020 Apr 1;6(4):495-503.
- Trewin-Nybråten CB, et al. Unveiling regional differences in glioblastoma patient survival with real-world data from the Norwegian brain tumor quality registry. J Neurooncol. 2025 Dec;175(3):1355-1366
- Cancer Registry of Norway. Annual report 2024: Results and improvement measures from the Norwegian Brain and Spinal Cord Tumour Registry. Årsrapport 2024: Resultater og forbedringstiltak fra Kvalitetsregister for hjerne- og ryggmargssvulster 2025.
- Karschnia P, et al. Prognostic validation of a new classification system for extent of resection in glioblastoma: A report of the RANO resect group. Neuro Oncol. 2023 May 4;25(5):940-954.
- Stummer W, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol. 2006;7(5):392–401.
- Dixon L, et al. Intraoperative ultrasound in brain tumor surgery: a review and implementation guide. Neurosurg Rev. 2022 Aug;45(4):2503-2515.
- Kubben PL, et al. Intraoperative MRI-guided resection of glioblastoma: a systematic review. Lancet Oncol. 2011;12(11):1062–1070.
- Roder C, et al. Intraoperative MRI versus 5-ALA for the resection of Glioblastoma: Update of survival data and correlation of imaging-based supramaximal resections according to the RANO resect classification system. EANS congress 2025, lecture
- Hervey-Jumper SL, Berger MS. Maximizing safe resection of low- and high-grade glioma. J Neurooncol. 2016;130(2):269–282.
- Gerritsen J, et al. Effect of awake craniotomy in glioblastoma in eloquent areas (GLIOMAP): a propensity score-matched analysis of an international, multicentre, cohort study. Lancet Oncol. 2022 Jun;23(6):802-817.
- Seidel K, et al. Motor evoked potential monitoring and continuous dynamic mapping: Warning criteria during surgery on motor eloquent intra-axial brain tumors. Clin Neurophysiol. 2025 Aug 15;178:2110979.
- Rossi M, et al. Resection of tumors within the primary motor cortex using high-frequency stimulation: oncological and functional efficiency of this versatile approach based on clinical conditions. J Neurosurg. 2019 Aug 9;133(3):642-654.
- Laigle-Donadey F, et al. Surgery for glioblastomas in the elderly: an Association des Neuro-oncologues d’Expression Française (ANOCEF) trial. J Neurosurg. 2022 Oct 14;138(5):1199-1205.
- Karschnia P, et al. Development and validation of a clinical risk model for postoperative outcome in newly diagnosed glioblastoma: A report of the RANO resect group. Neuro Oncol. 2025 May 15;27(4):1046-1060.
- Karschnia P, et al. Prognostic evaluation of re-resection for recurrent glioblastoma using the novel RANO classification for extent of resection: A report of the RANO resect group. Neuro Oncol. 2023 Sep 5;25(9):1672-1685.