Hvert år diagnostiseres mer enn 2 000 personer i Norge med nyoppstått svulst i hjerne, hjernehinner eller ryggmarg. Kvalitetsregister for hjerne- og ryggmargsvulster (Hjernesvulstregisteret) ble opprettet i 2021 for å styrke kvaliteten på diagnostikk og behandling, samt legge til rette for forskning. Denne artikkelen oppsummerer erfaringene med registeret til nå, og presenterer to vitenskapelige artikler basert på registerets datasett.
Bakgrunn
Kreftregisteret har samlet data om kreftforekomst i mer enn 70 år (1). Utviklingen av kvalitetsregistre på kreftområdet startet i 2004, og for de åtte største kreftformene er slike registre godt etablert (2). Hjernesvulstregisteret ble opprettet i 2021, finansiert av Kreftforeningen og Hjernesvulstforeningen etter et pårørendeinitiativ (3). Formålet er å styrke kvaliteten på helsehjelp til pasienter med svulst i sentralnervesystemet. Registeret skal i tillegg drive, fremme og gi grunnlag for forskning. Et annet mål er å oppnå formell status som nasjonalt medisinsk kvalitetsregister, for å sikre permanent finansiering og drift. Hjernesvulstregisteret ledes av Kreftregisteret ved Folkehelseinstituttet, som også har dataansvaret. Fagmiljøene i sykehusene er representert gjennom et bredt sammensatt fagråd hvor alle helseregioner er representert med medlemmer fra blant annet nevrokirurgi, onkologi, patologi og radiologi.
Metode
Hvilke pasienter skal registreres i Hjernesvulstregisteret?
Kreftregisterforskriften pålegger registrering av alle tilfeller av kreft, forstadier til kreft og godartede svulster i sentralnervesystemet. Det innebærer at alle primære intrakraniale og intraspinale svulster skal registreres. Dette i motsetning til svulster i andre organer, hvor kun kreft og forstadier til kreft blir registrert. Hjernesvulstregisteret omfatter derfor alle primære svulster i hjerne, ryggmarg og spinalkanal, hjerne- og ryggmargshinner, hypofyse, duktus kraniofaryngealis og korpus pineale. Enkelte svulsttyper som kan oppstå i hjernen (f.eks. lymfom, melanom og noen sjeldne bløtvevssvulster) registreres i egne sykdomsspesifikke registre. Metastaser til sentralnervesystemet registreres i kvalitetsregisteret for den primære kreftsykdommen.
Hvordan skjer registreringen?
Fram til og med 2023 ble hjerne- og ryggmargsvulster rapportert til Kreftregisteret via en generell klinisk melding for solide svulster. Dekningsgraden var lav – i 2023 var den 47 % for histologisk verifiserte svulster (4). I 2024 ble den generelle meldingen erstattet av to nye meldinger tilpasset hjerne- og ryggmargsvulster; én utredningsmelding og én kirurgisk melding. Begge er tilgjengelige i KREMT-portalen.
Ved diagnostisk biopsi eller reseksjon av hjerne- og ryggmargsvulster mottar Kreftregisteret patologiremisser fra sykehusene og registrerer informasjonen i et skjema for generell patologi i Hjernesvulstregisteret. Mottak av patologiremisser fra sykehusene anses å være tilnærmet komplett. Registeret mottar også data fra norsk pasientregister (NPR) (inkludert opplysninger om H-resepter), dødsårsaksregisteret, folkeregisteret, strålemaskinene og sykehusenes fagsystemer for medikamentell behandling (unntatt Helse Nord).
Hvem skal melde?
Det er lovpålagt for sykehus og helsepersonell å melde alle tilfeller av kreft, forstadier til kreft og godartede svulster i sentralnervesystemet til Kreftregisteret.
Sykehuset som først stiller diagnosen hjerne- eller ryggmargsvulst skal sende utredningsmelding. Dette gjelder uavhengig av videre henvisning (f.eks. til nevrokirurgisk eller onkologisk vurdering) eller hvor sikker diagnosen er, ettersom alle slike svulster er meldepliktige. Utredningsmelding skal for eksempel sendes ved tilfeldig funn av en liten høyattenuerende forandring forenlig med meningeom på CT, uavhengig av om pasienten henvises til nevrokirurgisk eller onkologisk vurdering. Det samme gjelder ved påvisning av hypofysesvulster som kun krever endokrinologisk oppfølging.
Kirurgimeldingen skal sendes av den nevrokirurgiske avdelingen som opererer pasienten.
Dekningsgrad og kompletthet
Figurene 1 og 2 viser at dekningsgraden i 2024 var 36 % for utredningsmeldingen (spredning 21–58 %) og 39 % for kirurgimeldingen (spredning 5-99 %) (5). Foreløpige data fra 2025 tyder på en klar økning i dekningsgraden for kirurgimeldingen. Den lave dekningsgraden for utredningsmeldingen er i stor grad forårsaket av at det ikke blir sendt melding om pasienter som ikke blir operert. Høyere dekningsgrad for utredningsmeldingen er derfor avgjørende for å vurdere forekomst, behandlingskvalitet og utfall hos pasienter som ikke opereres. Dette er et prioritert innsatsområde for registeret fremover.
For å kompensere for lav dekningsgrad for utredningsmeldingen suppleres datagrunnlaget fra og med årsrapporten for 2024 med diagnosekoder fra NPR for å øke komplettheten av hjerne- og ryggmargsvulster i Hjernesvulstregisteret. Det er imidlertid usikkerhet knyttet til fullstendighet og korrekthet i NPR for pasienter uten histologisk verifisert diagnose, og bruk av diagnosekoder fra NPR medfører sannsynligvis fortsatt underrapportering av godartede svulster som for eksempel meningeom. Komplettheten for ondartede gliomer, som oftest får en histologisk verifisert diagnose, er derimot beregnet til 98,8 % i perioden 2002–2021 (6).
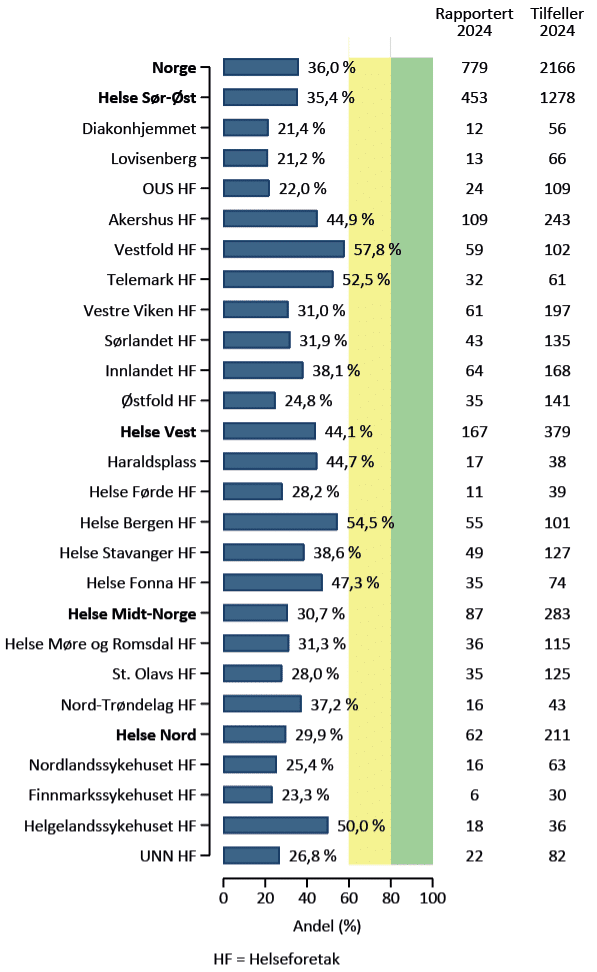
Figur 1. Dekningsgrad for utredningsmelding per bostedsområde, 2024 (n=2 166). Figuren viser hvor pasienten var bosatt, og ikke hvilket sykehus som leverte utredningsmelding. Figuren er hentet fra registerets årsrapport for 2024 (5).

Figur 2. Dekningsgrad for kirurgimelding per operasjonssykehus, 2024 (n=850). Figuren er hentet fra registerets årsrapport for 2024 (5).
Klassifisering
Svulster i sentralnervesystemet klassifiseres i henhold til Verdens helseorganisasjons (WHOs) system. I 2021 publiserte WHO en ny versjon med betydelige endringer i nomenklatur og integrering av molekylære markører i klassifiseringen (7). Hjernesvulstregisteret innførte denne klassifikasjonen fra og med 2023. Endringene gjør det utfordrende å analysere tidsserier, siden data før og etter 2023 ikke er direkte sammenlignbare.
Hjerne- og ryggmargsvulster i Norge i 2024
I 2024 ble det ble registrert 2 252 nye tilfeller av hjerne- og ryggmargsvulster i Norge (tabell 1) (5). De største histologisk verifiserte gruppene var 390 (17 %) meningeomer, 347 (15 %) gliomer og 138 (6 %) hypofyseadenomer. Tilsammen 979 tilfeller (43 %) ble registrert kun på grunnlag av diagnosekoder i NPR, fordelt på 287 (13 %) svulster i hjerne- og ryggmargshinner, 222 (10 %) i hjerne og ryggmarg og 470 (21 %) i hypofyseområdet. Disse 979 tilfellene lar seg ikke klassifisere nærmere fordi informasjon om histologisk subtype ikke foreligger.
Den samlede insidensen i perioden 2020-2024 var 49 nyoppståtte svulster per 100 000 personår: 22 for hjerne- og ryggmargsvulster, 16 for hjerne- og ryggmargshinnesvulster og 12 for svulster i hypofyseområdet (tabell 1). Det var små forskjeller mellom regionene, bortsett fra at insidensen for meningeom varierte fra 7 per 100 000 i Midt-Norge til 11 i Nord-Norge. Forskjellen var størst i aldersgruppene over 60 år, og kan reflektere variasjon i tilgang til og bruk av diagnostikk (hovedsakelig MR), eller ulikheter i melderutiner til NPR og Kreftregisteret.
Registeret har til nå ikke presentert kjønnsstratifiserte analyser i årsrapportene.
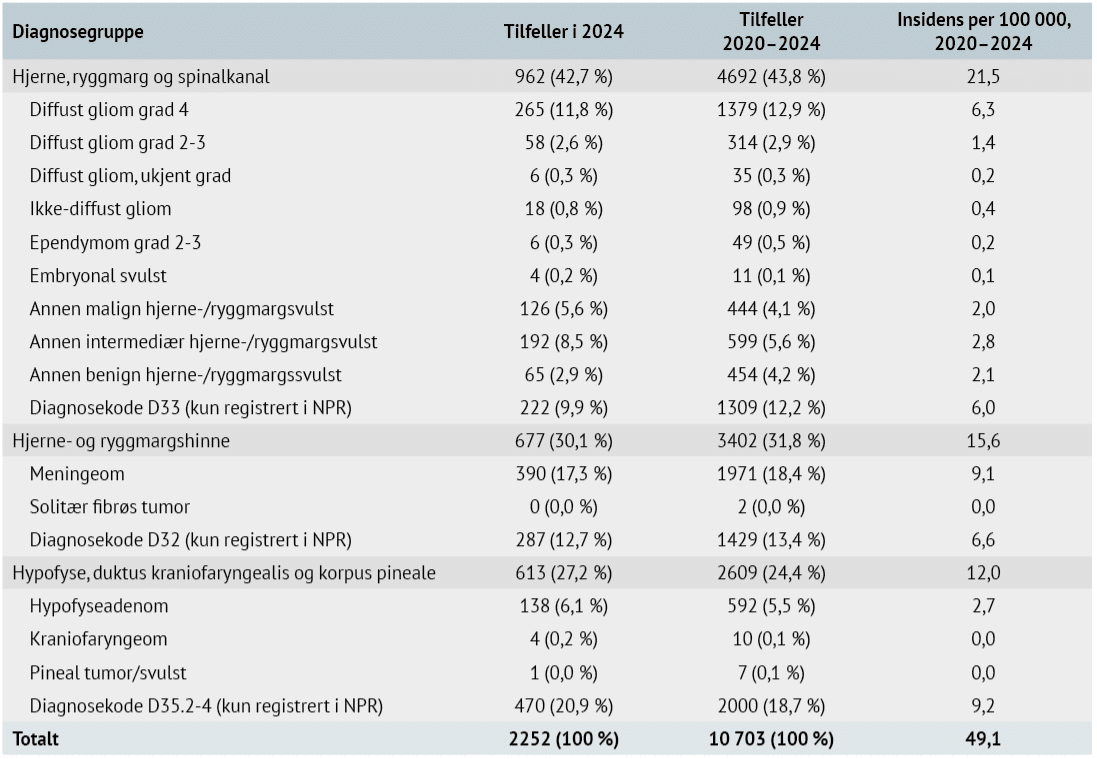
Tabell 1. Antall tilfeller inkludert i Hjernesvulstregisteret per diagnosegruppe og insidens per 100 000 personår, 2020–2024. Tall er hentet fra registerets årsrapport for 2024 (5).
NPR = Norsk pasientregister
Forekomst og dødelighet av gliom
Av de primære svulstene som utgår fra selve hjernevevet er gliom den vanligste typen. Gliomene har karakteristika som ligner hjernens støtteceller, gliacellene. Malignitetsgrad klassifiseres etter WHO fra grad 1 (lav) til 4 (høy). Den hyppigste undergruppen er glioblastom (WHO grad 4), som i Norge hadde median overlevelse på bare 11,7 måneder etter diagnose i perioden 2012–2017 (8, 9).
Vi analyserte tidstrender i forekomst og dødelighet av gliom hos 7 048 pasienter behandlet i perioden 2002–2021 med data fra hjernesvulstregisteret. Resultatene er publisert i en vitenskapelig artikkel i Acta Oncologica (6). De aldersstandardiserte insidensratene var stabile gjennom perioden (figur 3). Forekomsten var høyere hos menn enn kvinner, både samlet (8,8 versus 6,1 per 100 000 personår) og for glioblastom spesielt (5,1 hos menn versus 3,4 hos kvinner per 100 000 personår).
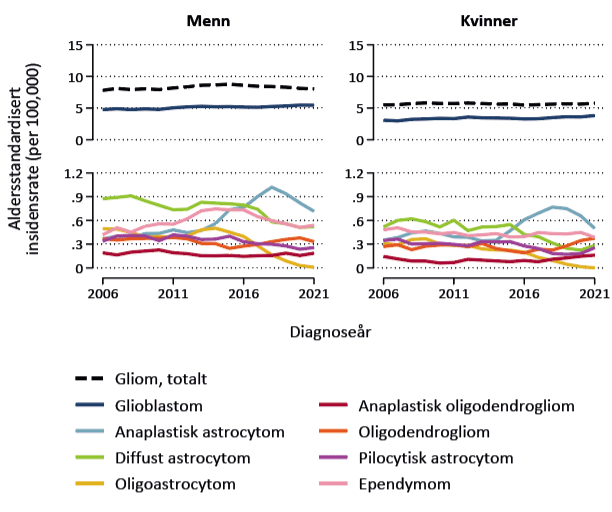
Figur 3. Aldersstandardisert insidensrate per 100 000 personår for histologisk verifiserte gliomer, 2002–2021 (n=6 476). Figuren viser femårig rullerende gjennomsnitt for insidensrater som er standardisert til aldersfordeling av gliompasienter i 2021. Adaptert fra Skaga et al. (6) med tillatelse under Creative Commons Licence versjon 4.0 (https://creativecommons.org/licenses/by/4.0/).
Den relative overlevelsen varierte betydelig mellom subtypene av gliom, fra 51,8 % og 7,6 % etter henholdsvis ett år og fem år for glioblastom, til 97,0 % og 84,9 % etter ett år og fem år for oligodendrogliom. Figur 4 viser at den relative overlevelsen økte gjennom nesten 20 år for de fleste gliomtyper. For glioblastom økte 12-måneders relativ overlevelse fra 45 % i 2002–2006 til 59 % i 2017–2021, mens medianoverlevelse økte fra 10 til 13 måneder. Forbedringene kan trolig forklares med økt bruk av tidlig og omfattende reseksjon av lavgradige gliomer, samt innføringen av kjemoterapien temozolomid i behandlingen av glioblastom (10, 11). Økt bruk av komplett reseksjon av de kontrastoppladende delene av glioblastomer kan også ha bidratt (12).
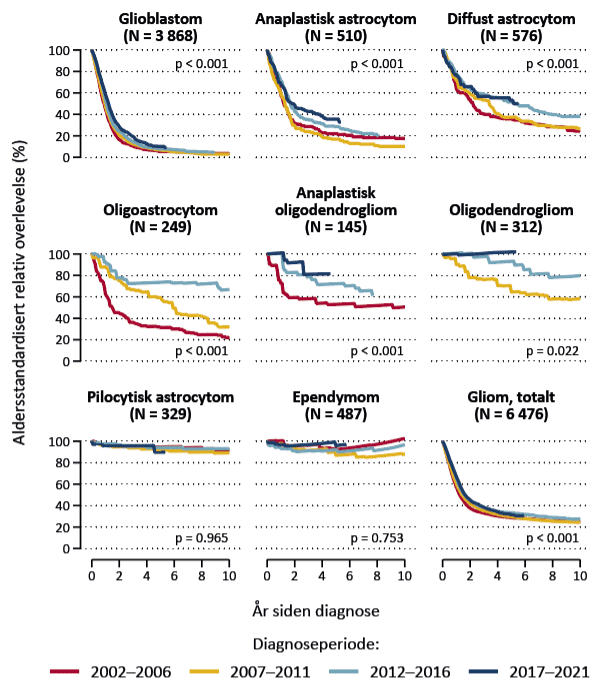
Figur 4. Aldersstandardisert relativ overlevelse for histologisk verifiserte svulster, fordelt på diagnoseperiode, 2002–2021 (n=6 476). Figuren viser p-verdier for tidstrend for relativ overlevelse gjennom periodene 2002-2006, 2007-2011, 2012-2016 og 2017-2021 i Cox regresjon justert for alder. Adaptert fra Skaga et al. (6) med tillatelse under Creative Commons Licence versjon 4.0 (https://creativecommons.org/licenses/by/4.0/).
Regionale forskjeller i diagnostikk og behandling av gliomer
I arbeidet med artikkelen om forekomst og dødelighet av gliomer ble det også observert at både forekomsten og dødeligheten for histologisk verifisert glioblastom var høyere i Helse Nord enn i de andre helseregionene. Dette ble undersøkt nærmere i en studie publisert i Journal of Neuro-Oncology (13).
Vi fant at hovedårsaken til høy forekomst av histologisk verifisert glioblastom i Helse Nord var en høy kirurgirate. Dette skyldtes i hovedsak mer bruk av diagnostiske biopsier blant pasienter over 70 år enn i de andre helseregionene (figur 5a). Vi fant også at en høyere andel opererte pasienter over 70 år i Helse Nord ikke fikk onkologisk behandling med stråling og temozolomid (figur 5b). Dette sammenfalt med høyere dødelighet i samme aldersgruppe de første seks månedene etter operasjonen (figur 6b). For pasienter under 70 år var det ingen regionale forskjeller i behandling eller dødelighet (figurene 5a, 5b og 6a).

Figur 5. Regionale forskjeller i A) aldersspesifikk kirurgirate for glioblastom (antall operasjoner per 100 000 innbyggere per region per år) og B) andel pasienter som ikke har fått strålebehandling eller temozolomid, 2019–2023 (n=1 158). Adaptert fra Trewin-Nybråten et al. (13) med tillatelse under Creative Commons Licence versjon 4.0 (https://creativecommons.org/licenses/by/4.0/).
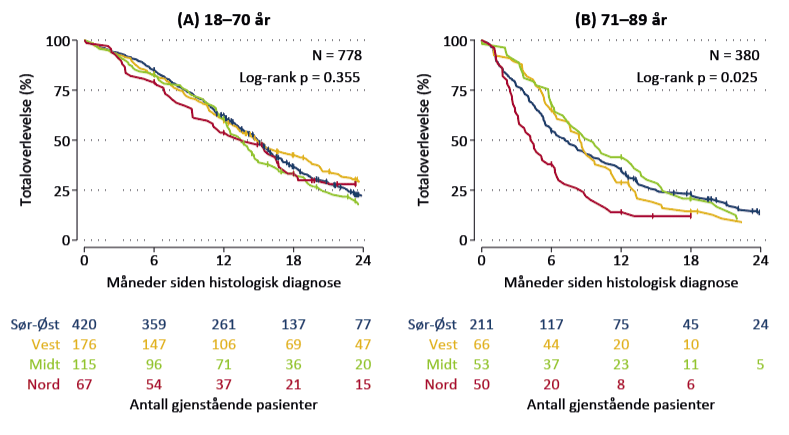
Figur 6. Regionale forskjeller i overlevelse for pasienter med histologisk verifisert glioblastom A) 18-70 år (n=778) og B) 71-89 år, 2019–2023 (n=380). Adaptert fra Trewin-Nybråten et al. (13) med tillatelse under Creative Commons Licence versjon 4.0 (https://creativecommons.org/licenses/by/4.0/).
Samlet tyder funnene på at Helse Nord i større grad enn de andre regionene gjennomførte diagnostiske biopsier hos eldre, skrøpelige pasienter som i liten grad fikk svulstrettet kreftbehandling. Tilsvarende pasienter ble trolig håndtert kun med bildediagnostikk og døde sannsynligvis tidlig også i de andre regionene. Vi kan imidlertid ikke belegge denne tolkningen med data på grunn av lav dekningsgrad for kliniske meldinger, som er nødvendige for å registrere tilfeller som får diagnose kun basert på bildediagnostikk i Hjernesvulstregisteret.
Universitetssykehuset Nord-Norge (UNN) vurderer nå om det bør gjøres færre diagnostiske biopsier hos gamle skrøpelige pasienter med sannsynlig glioblastom basert på bildediagnostikk. Dette for å redusere unødvendig risiko for pasienter og for å unngå unødvendig ressursbruk.
Kvalitetsindikatorer
Nasjonale medisinske kvalitetsregistre gir strukturert informasjon om pasientbehandling, og benyttes til å vurdere og forbedre kvaliteten i helsetjenesten gjennom kvalitetsindikatorer (14). Fra 2024 innførte Hjernesvulstregisteret fire kvalitetsindikatorer basert på observasjoner av uønsket praksisvariasjon og anbefalingene i handlingsprogrammene for hjernesvulster (15, 16). Figur 7 viser at måloppnåelsen foreløpig er moderat. Kvalitetsindikatorene er de følgende:
1. Andel pasienter med første kirurgiske inngrep mot diffust gliom grad 4 (inklusive glioblastom) som mottar svulstrettet onkologisk behandling bør være ≥ 90 %. Fagrådet anbefaler tilbakeholdenhet med kirurgisk diagnostikk og behandling når det foreligger en rimelig sikker radiologisk diagnose, og pasientens tilstand tilsier at annen svulstrettet onkologisk behandling ikke er aktuelt. Indikatoren baserer seg på studien om geografisk variasjon i overlevelse (13), og måloppnåelsen var lavest i Helse Nord i 2024 (71 %).
2. Andelen pasienter med gliom og meningeom som får postoperativ MR innen 72 timer fra kirurgi bør være ≥ 95 %. Fagrådet anser postoperativ MR som viktig både for å vurdere om reseksjonen er utført i planlagt omfang, og for å legge grunnlag for videre onkologisk behandling. Andelen var i 2024 på 92 %, altså ikke langt under måltallet.
3. Median tid fra kirurgisk inngrep til oppstart av strålebehandling for pasienter under 70 år med glioblastom bør være ≤ 21 dager. Ventetid etter en histologisk verifisert diagnose er belastende for pasientene. I 2024 var måloppnåelsen moderat med median ventetid 28 dager og liten variasjon mellom regionene.
4. Median tid fra kirurgisk inngrep mot glioblastom til svar på MGMT-analyse bør være ≤ 14 dager. Metyleringsgrad av promotorregionen til MGMT-genet er en etablert biomarkør som predikerer respons på kjemoterapi med temozolomid for pasienter med glioblastom. Kort svartid er avgjørende for å planlegge videre behandling, vurdere inklusjon i kliniske studier, og gi pasienten tidlig informasjon om prognose. I 2024 var median svartid 20 dager, med forbedringspotensial særlig ved Oslo universitetssykehus (22 dager) og UNN (20 dager).
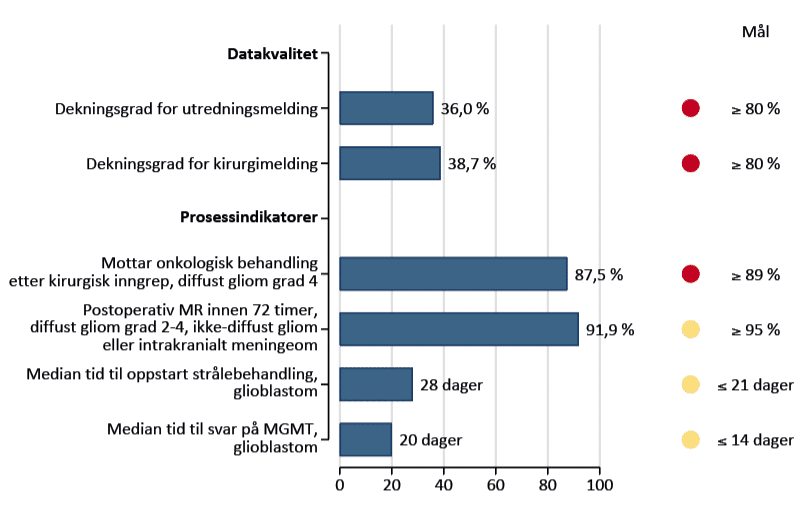
Figur 7. Kvalitetsindikatorer, 2024. Rød, gul og grønn sirkel betyr henholdsvis lav, moderat og høy måloppnåelse. Figuren er hentet fra registerets årsrapport for 2024 (5).
Diskusjon og konklusjon
Hjernesvulstregisteret er godt etablert bare fire år etter oppstart. Registeret har allerede bidratt med viktige vitenskapelige analyser og lagt grunnlag for etablering av kvalitetsindikatorer. Som en direkte følge av arbeidet med Hjernesvulstregisteret er det igangsatt kvalitetsforbedringsarbeid ved flere sykehus i 2025, og det er sannsynlig at kommende årsrapporter vil dokumentere resultater av dette arbeidet.
Registerets største utfordring er den lave dekningsgraden for utredningsmeldingen. En høyere dekningsgrad er en forutsetning for å kunne vurdere behandlingskvaliteten for pasienter som ikke blir operert, og som dermed mangler histologisk verifisert diagnose. Alle sykehus som stiller diagnosen hjerne- eller ryggmargsvulst har meldeplikt, og registeret fortsetter arbeidet med å øke bevisstheten rundt dette.
De fire kvalitetsindikatorene måler prosesskvalitet. Postoperativ dødelighet og overlevelse er foreløpig de eneste tilgjengelige resultatindikatorene. Det er velkjent at pasienter som lever med kreftsykdom kan ha betydelig nedsatt funksjonsevne og livskvalitet (17, 18). Pasientene kan også bidra med erfaringer som er verdifulle i kvalitetsforbedringsarbeid. Derfor er det ønskelig å inkludere pasientrapporterte utfall (patient-reported outcome measures; PROM) og erfaringer (patient-reported experience measures; PREM). Innsamling av slike data er krevende blant pasienter med kognitiv svikt eller kort forventet levetid, men registeret planlegger likevel en pilot i 2026, i første omgang for pasienter med histologisk verifisert diffust lavgradig gliom og meningeom.
Fagrådet vurderer etableringen av registeret som vellykket, og anbefaler at helsemyndighetene godkjenner Hjernesvulstregisteret som nasjonalt medisinsk kvalitetsregister, med tilhørende permanent finansiering og drift.
Referanser:
1. Grimsrud TK. 70 years of the Cancer Registry of Norway. Tidsskr Nor Laegeforen. 2022;142(18).
2. Dørum LM. Historien om kvalitetsregistrene. Norsk Epidemiologi. 2022;30(1-2):35–40.
3. Cancer Registry of Norway. Annual report 2022: Results and improvement measures from the Norwegian Brain and Spinal Cord Tumour Registry. Årsrapport 2022: Resultater og forbedringstiltak fra Kvalitetsregister for hjerne- og ryggmargssvulster2023. Available from: https://www.fhi.no/globalassets/publikasjoner-og-rapporter/arsrapporter/publisert-2023/arsrapport-2022-nasjonalt-kvalitetsregister-for-hjerne–og-ryggmargssvulster.pdf.
4. Cancer Registry of Norway. Annual report 2023: Results and improvement measures from the Norwegian Brain and Spinal Cord Tumour Registry. Årsrapport 2023: Resultater og forbedringstiltak fra Kvalitetsregister for hjerne- og ryggmargssvulster 2024. Available from: https://www.fhi.no/globalassets/publikasjoner-og-rapporter/arsrapporter/publisert-2024/arsrapport-2023-kvalitetsregister-for-hjerne–og-ryggmargssvulster.pdf.
5. Cancer Registry of Norway. Annual report 2024: Results and improvement measures from the Norwegian Brain and Spinal Cord Tumour Registry. Årsrapport 2024: Resultater og forbedringstiltak fra Kvalitetsregister for hjerne- og ryggmargssvulster 2025. Available from: https://www.fhi.no/publ/2025/kvalitetsregister-for-hjerne-og-ryggmarssvulster-2024/.
6. Skaga E, Trewin-Nybråten CB, Niehusmann P, Johannesen TB, Marienhagen K, Oltedal L, et al. Stable glioma incidence and increased patient survival over the past two decades in Norway: a nationwide registry-based cohort study. Acta Oncol. 2024;63:83–94.
7. Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021;23(8):1231–51.
8. Schipmann-Miletic S, Sivakanesan S, Rath DS, Brandal P, Vik-Mo E, Bjørås M, et al. [Glioblastoma in adults]. Tidsskr Nor Laegeforen. 2023;143(2).
9. Skaga E, Skretteberg MA, Johannesen TB, Brandal P, Vik-Mo EO, Helseth E, et al. Real-world validity of randomized controlled phase III trials in newly diagnosed glioblastoma: to whom do the results of the trials apply? Neurooncol Adv. 2021;3(1):vdab008.
10. Jakola AS, Skjulsvik AJ, Myrmel KS, Sjåvik K, Unsgård G, Torp SH, et al. Surgical resection versus watchful waiting in low-grade gliomas. Ann Oncol. 2017;28(8):1942–8.
11. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987–96.
12. Mendoza Mireles EE, Skaga E, Server A, Leske H, Brandal P, Helseth E, et al. The benefit of complete resection of contrast enhancing tumor in glioblastoma patients: A population-based study. Neurooncol Pract. 2023;10(6):555–64.
13. Trewin-Nybråten CB, Lambert PC, Marienhagen K, Andreassen L, Johannesen TB, Niehusmann P, et al. Unveiling regional differences in glioblastoma patient survival with real-world data from the Norwegian brain tumor quality registry. J Neurooncol. 2025.
14. Senter for klinisk dokumentasjon og evaluering. Registerdrift – Kvalitetsindikatorer. [updated 25.09.2024; cited 2025 16.10.2025]. Available from: https://www.kvalitetsregistre.no/registerdrift/kvalitetsindikatorer/.
15. Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av meningeomer. 2020. Available from: https://www.helsedirektoratet.no/retningslinjer/meningeomer-hos-voksne-handlingsprogram.
16. Helsedirektoratet. Nasjonal faglig retningslinje for diagnostikk, behandling og oppfølging av diffuse gliomer hos voksne. 2023. Available from: https://www.helsedirektoratet.no/retningslinjer/diffuse-gliomer-hos-voksne-handlingsprogram.
17. Gjelsvik YM, Trewin-Nybråten CB, Balto A, Myklebust TÅ, Johannesen TB, Nilsson M, et al. Cancer in Norway – Spesialutgave 2024 – Livet etter kreftdiagnosen, utvidet versjon.2025. Available from: https://www.fhi.no/publ/2025/livet-etter-kreftdiagnosen/.
18. Liu R, Page M, Solheim K, Fox S, Chang SM. Quality of life in adults with brain tumors: current knowledge and future directions. Neuro Oncol. 2009;11(3):330–9.