Stråleknivbehandling representerer en kirurgisk presisjonsmetode for behandling av intrakranielle svulster. Selv om teknologien bygger på strålefysikk, er behandlingstradisjonen og -filosofien kirurgisk: én presis intervensjon, uten marginer, med mål om lokal kontroll og bevart funksjon. Etter snart 40 år i drift ved Haukeland universitetssjukehus har strålekniven blitt et nasjonalt nevrokirurgisk verktøy, brukt både ved benigne og maligne hjernesvulster.
Et nevrokirurgisk verktøy
På begynnelsen av 1900-tallet utviklet nevrokirurgen Victor Horsley og fysikeren Robert Clarke et tredimensjonalt koordinatsystem som gjorde det mulig å lokalisere strukturer i hjernen med høy presisjon (1). Instrumentet – senere kjent som den stereotaktiske rammen – ble brukt til å lage kontrollerte lesjoner i forsøksdyr og dannet grunnlaget for det som i dag omtales som det stereotaktiske prinsipp. I 1947 tilpasset Ernest A. Spiegel og nevrokirurgen Henry T. Wycis teknologien til klinisk bruk og utviklet den første rammen for menneskelig nevrokirurgi (2). Gjennom 1950-årene videreutviklet blant andre nevrokirurgene Lars Leksell og Jean Talairach prinsippene og etablerte rammen som et sentralt nevrokirurgisk verktøy (3). I dag brukes den til dyp hjernestimulering, biopsier og presis strålebehandling.
Strålekniven springer direkte ut av dette miljøet. På slutten av 1940-tallet kombinerte Leksell den stereotaktiske rammen med målrettet stråling for å behandle intrakranielle lesjoner – en metode han kalte stereotaktisk strålekirurgi (4). Etter forsøk med røntgen og protoner utviklet han sammen med fysikeren Börje Larsson på 1950-tallet den første strålekniven basert på kobolt-60 som strålekilde. Teknologien ble kommersialisert og spredt internasjonalt på 1980-tallet, og indikasjonene for behandling utvidet seg i takt med bruken. Haukeland universitetssjukehus installerte den første strålekniven i 1988 og har siden hatt en operativ strålekniv. Den historiske forankringen er avgjørende for å forstå at strålekniven er et nevrokirurgisk verktøy, utviklet av og for nevrokirurger, selv om behandlingsmetoden med stråling i dag regnes som «onkologisk».
Brennpunkt i stereotaktisk ramme
Strålekniven er et system for presis bestråling av lesjoner i hjernen. Prinsippet bygger på at vel 200 svake stråler fra kobolt 60-kilder møtes i ett punkt hvor stråledosen summeres mens omkringliggende vev får lav eksponering; omtrent som solstrålene i et forstørrelsesglass (5). Metoden gjør det mulig å behandle små målvolum med høy nøyaktighet og minimal belastning på normal hjerne.
Behandlingen utføres vanligvis som en engangsbehandling under stereotaktisk rammefiksering. Rammen holder hodet helt stille og danner et koordinatsystem som kobles direkte til MR- og CT-bildene som brukes i planleggingen. Dette gjør det mulig å levere stråledosen med submillimeterpresisjon.
Stråleknivbehandling skiller seg fra konvensjonell stråleterapi ved både dosefordeling og presisjon. Konvensjonell behandling har bredere dosefall, bruker marginer for å kompensere for variasjoner i pasientens posisjon og fordeler dosen over flere fraksjoner med maskefiksering. Parallelt med stråleknivens utvikling har også stereotaktiske lineærakseleratorer (linac) kommet til. Stråleknivbehandling og linac er metoder som nærmer seg hverandre. Likevel er det viktige forskjeller mellom stråleknivbehandling og «stereotaktisk linac» da metodene springer ut fra ulike miljøer, henholdsvis nevrokirurgien og onkologien (3). Linac brukes hovedsakelig ved kreftsykdom og kan anvendes utenfor hodet, mens strålekniven også brukes ved ikke-onkologiske tilstander og er begrenset til det intrakranielle området (4, 6).
Planleggingen er en kirurgisk beslutningsprosess, ikke en standardisert protokoll. Nevrokirurgen vurderer forholdet mellom lesjon og risikoorganer – for eksempel synsnerver, hjernestamme, cochlea og motorisk cortex – og tilpasser dosefordelingen med mange små isosentre på 4, 8 eller 16 mm, justert med submillimeterpresisjon.
Nasjonal behandlingstjeneste i strålekniv
Strålekniven ved Haukeland universitetssjukehus ble installert i 1988 og har siden 1991 vært organisert som Nasjonal behandlingstjeneste i strålekniv. Om lag 500 pasienter behandles årlig, og over ti tusen er behandlet siden oppstarten. Det særegne ved tjenesten er ikke lenger selve presisjonsstrålingen – det tilbyr også moderne lineærakseleratorer og protonterapi – men at virksomheten springer ut fra nevrokirurgisk tradisjon og omfatter også ikke-onkologiske tilstander som cerebrale karmalformasjoner, tremor, trigeminusnevralgi og hypofysær overproduksjon.
Tjenesten er tverrfaglig, med fem nevrokirurger, medisinske fysikere og spesialsykepleiere, og drives som et kirurgisk behandlingsmiljø i nært samarbeid med nevroradiologi og onkologi. Pasientene henvises ferdig utredet, og oppfølging skjer lokalt etter diagnosebaserte retningslinjer.
Siden etableringen har miljøet publisert over seksti vitenskapelige arbeider, bidratt til flere doktorgrader og deltatt aktivt i internasjonale nettverk som International Stereotactic Radiosurgery Society (ISRS) og European Society for Stereotactic and Functional Neurosurgery (ESSFN).
Behandlingen utføres som regel poliklinisk eller som et kort innleggelsesforløp. Om morgenen festes pasientens hode i en stereotaktisk ramme med fire små skruer under lokalbedøvelse, eventuelt med lett sedasjon (bilde 1). Ubehaget kan sammenlignes med et tannlegebesøk – ikke behagelig, men fullt gjennomførbart – og mange opplever at den største belastningen er knyttet til det ukjente, noe som kan forebygges med god informasjon på forhånd. Rammen gir både mekanisk stabilitet og geometrisk referanse, eliminerer bevegelse og muliggjør ekstrem presisjon. Dette er en forutsetning for at bestrålingen kan gis som en nøyaktig engangsintervensjon uten marginer.
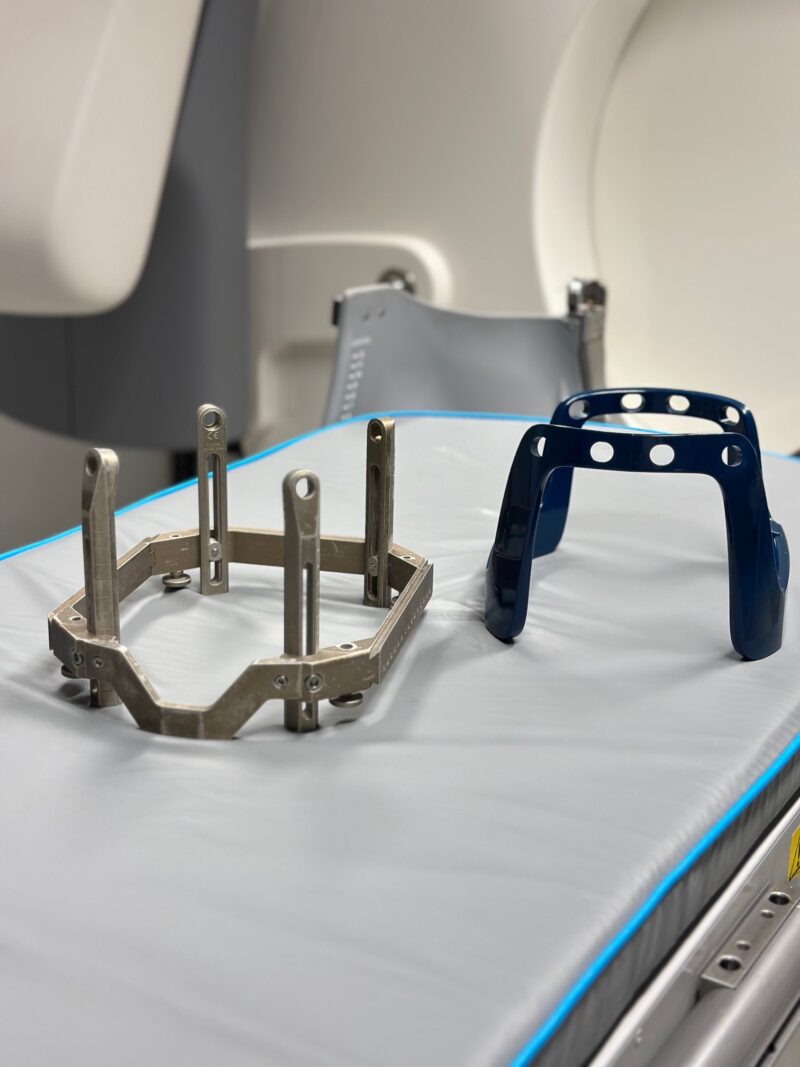
Bilde 1: Stereotaktiske rammer til kranial montering, henholdsvis Leksell® Coordinate Frame G («G-rammen») og Leksell® Vantage™ Head Frame («V-rammen»). Foto: Øystein Tveiten
Når rammen er festet, tas MR og eventuelt CT eller angiografi. Bildene importeres i planleggingssystemet der nevrokirurg og medisinsk fysiker utarbeider behandlingsplanen. Vanlig dosering er 12–14 Gy ved godartede svulster og 18–25 Gy ved ondartede, avhengig av størrelse, lokalisasjon og avstand til risikostrukturer. Selve bestrålingen varer fra noen minutter til opptil to timer. Rammen fjernes umiddelbart etterpå, og pasienten kan som regel reise hjem samme dag.
Bivirkningene er som regel milde og forbigående. Enkelte får hodepine, kvalme eller lett hevelse som går tilbake med kort steroidkur. Risikoen for varige senskader som strålenekrose er lav – under tre prosent ved korrekt planlegging.
Størrelsen på normalt hjernevev som mottar 12 Gy – det såkalte V12 – angir i praksis den øvre volumgrensen for trygg behandling. Selv om vi for enkelhets skyld ofte oppgir 3 cm som øvre diametergrense, er den funksjonelle grensen rundt 10–15 cm³. Har man to eller flere lesjoner, bør samlet volum ikke overstige dette, men grensen påvirkes også av lokalisasjon i hjernen: Ligger lesjonene nær ventrikler eller hjerneoverflate, vil en del av dosefallet utenfor lesjonen gå i henholdsvis vann og bein. Formelen for kulevolum er V = 4/3 πr³, og en kule med diameter på 3 cm har et volum på 14,1 cm³ (bilde 2).

Bilde 2: Volumberegning: En diameter på 3 cm tilsvarer ca. 15 cm³ som er ca. øvre begrensning av hva vi kan behandle med ufraksjonert, stereotaktisk stråling i hjernen. Illustrasjon: Øystein Tveiten
Hensikten med behandlingen
Målet med stråleknivbehandling av hjernesvulster er «svulstkontroll», det vil si at svulsten slutter å vokse eller holder seg stabil. Målsetningen er ikke nødvendigvis volumreduksjon, selv om det noen ganger er fordelaktig. Ikke alle svulster responderer med volumreduksjon, og denne prosessen tar gjerne måneder og år. Pasienter med symptomer fra masseffekt bør derfor vurderes for operativ behandling – i alle fall før stråleknivbehandling. Dette prinsippet gjelder for eksempel ved enkelte store vestibularisschwannom, der vi først reduserer volumet operativt og senere kan behandle restsvulsten langs n. facialis med strålekniv (7). Dette gjør at asymptomatiske, men voksende svulster ofte er best egnet for stråleknivbehandling. I enkelte tilfeller behandler vi også med mål om symptomlindring, særlig ved svulster som er vanskelig tilgjengelige for kirurgi, som meningeomer i sinus cavernosus. Ved hormonelt aktive hypofyseadenomer, som prolaktinom og Cushings sykdom, kan formålet være både svulstkontroll og normalisering av hormonproduksjonen.
Kliniske indikasjoner
Ved Nasjonal behandlingstjeneste i strålekniv behandles et bredt spekter av intrakranielle tilstander. Som figur 3 viser, utgjør hjernemetastaser den største gruppen, etterfulgt av meningeomer, vestibularisschwannomer og hypofyseadenomer. I tillegg behandles en mindre andel vaskulære og funksjonelle lidelser, som arteriovenøse malformasjoner, trigeminusnevralgi og tremor, samt enkelte gliomresidiv og andre sjeldne tilstander.

Bilde 3: Behandlingsindikasjoner ved Nasjonal behandlingstjenester i strålekniv i 2024. Illustrasjon: Øystein Tveiten
Vestibularisschwannom
Vestibularisschwannom er en langsomtvoksende svulst på n. vestibulocochlearis som vanligvis gir ensidig hørselstap, tinnitus, svimmelhet og balansevansker. De fleste oppstår sporadisk, men enkelte forekommer som ledd i NF2-relatert schwannomatose. Svulsten utgjør om lag 80 % av alle prosesser i cerebellopontine vinkel, og rundt 250 pasienter får diagnosen årlig i Norge (8). De fleste svulstene er små til mellomstore (< 2,5 cm) på diagnosetidspunktet. Selv om sykdommen har et godartet forløp, kan den gi betydelige og vedvarende plager, også når svulsten er liten (8, 9).
Små og mellomstore vestibularisschwannom følges som regel med MR, og behandling vurderes dersom svulsten viser vekst. Omtrent to tredeler av ubehandlede svulster vokser innen to år, men noen forblir stabile eller krymper spontant (8-10). I vår studie av nydiagnostiserte pasienter endte 40 % av de observerte med behandling innen fire år etter diagnosen (11). Små og mellomstore svulster som fremviser vekst, behandles som regel med strålekniv. Store svulster (> 2,5 cm) som komprimerer hjernestammen og gir symptomer fra masseffekt, behandles vanligvis operativt og signifikant restsvulst eller senere residiv kan behandles med strålekniv. Stråleknivbehandling er dermed etablert som et trygt og effektivt alternativ for svulstkontroll, både primært og ved rest- eller residivsvulst etter kirurgi.
Kontrollraten er rundt 95 %, med bevart facialis- og trigeminusfunksjon hos de fleste og hørselspreservasjon hos 40–80 % (12). Pseudoprogresjon forekommer hos 20–30 % de første tre årene og er som regel forbigående (12, 13). Om lag én av fem opplever midlertidig symptomforverring etter behandling, men sammenlignet med symptomer ved behandling er disse oftest uendret i langtidsforløpet – bortsett fra gradvis hørselstap tilsvarende det som sees ved konservativ behandling (11, 14). Den randomiserte V-REX-studien viste at tidlig stråleknivbehandling ga bedre volumkontroll enn observasjon, men uten forskjell i hørsel, balanse eller livskvalitet etter fire års oppfølging (11).
Meningeom
I likhet med vestibularisschwannom er meningeomer som oftest langsomtvoksende og godartede (WHO grad 1). De varierer fra store, symptomgivende svulster som krever kirurgi til små, tilfeldig påviste forandringer uten klinisk betydning. Økt MR-bruk har ført til hyppigere funn av små, asymptomatiske meningeomer som ofte følges konservativt (15). Derfor er det tenkelig at flere meningeomer vil behandles stereotaktisk i fremtiden.
Stråleknivbehandling har en sentral plass i behandlingen av meningeomer og er etablert som primær- eller adjuvant metode ved små og mellomstore svulster, særlig i skallebasis eller ved residiv etter kirurgi (18-20). For svulster nær viktige nevrovaskulære strukturer, som sinus cavernosus- eller petroklivale meningeomer, foretrekkes ofte stereotaktisk strålebehandling fremfor kirurgi, ettersom radikal reseksjon sjelden oppnås eller medfører høy morbiditet (21-24).
Svulstkontrollen etter stråleknivbehandling av meningeomer er høy. Moderne serier viser 5-års progresjonsfri overlevelse på 90–98 % og 10-års på 85–95 % for WHO grad 1-svulster, med randdoser på 12–14 Gy (22-28). I en multisenterstudie med over 1200 sinus cavernosus-meningeomer oppnådde man lokal kontroll hos 95 %, og progresjonsfri overlevelse på 97 % og 90 % på henholdsvis kort og lang sikt, mens varige komplikasjoner forekom hos om lag 6 % (24). Dette samsvarer med våre egne erfaringer (29).
Stråleknivbehandling egner seg særlig for små meningeomer (< 2,5–3 cm) med vekstpotensial der kirurgi er uønsket, for eksempel etter pasient-/behandlerønske eller ved utilgjengelig lokalisasjon. Ved inkomplett reseksjon eller residiv kan adjuvant stråleknivbehandling gi langtids svulstkontroll tilsvarende total reseksjon.
Hypofyseadenom
Hypofyseadenomer er godartede svulster som utgår fra adenohypofysen og utgjør 10–15 % av alle intrakraniale svulster. De deles i funksjonelle og ikke-funksjonelle adenomer, avhengig av om de produserer hormoner som prolaktin, veksthormon eller ACTH. Funksjonelle adenomer kan gi akromegali, Cushings sykdom eller hyperprolaktinemi, mens ikke-funksjonelle adenomer ofte oppdages ved synsfeltutfall, hodepine eller som tilfeldig funn. De fleste vokser langsomt, men kan gi symptomer ved trykk mot nærliggende strukturer som sinus cavernosus (a. carotis interna, hjernenervene for øyebevegelse og trigeminusgrenene V1 og V2) eller chiasma opticum (30-32).
Behandlingen av hypofyseadenom er multimodal og kan være konservativ, medikamentell (for eksempel dopaminagonister ved prolaktinom), kirurgisk eller stereotaktisk – ofte i kombinasjon. Utenom prolaktinom er kirurgi, vanligvis transsfenoidal, primærbehandling og gir høy kurasjonsrate med lav komplikasjonsrisiko (30). Ved rest- eller residivsvulster nær a. carotis har stråleknivbehandling fått en sentral rolle. Den gis som regel i doseområdet 12-16 Gy ved ikke-funksjonelle og 18–25 Gy ved funksjonelle adenomer, begrenset av nærhet til synsnerver, normal hypofyse eller nerver i sinus cavernosus (33, 34).
Vi oppnår lokal svulstkontroll hos om lag 95 % og endokrin remisjon hos 40–50 % ved akromegali og Cushings sykdom. Alvorlige bivirkninger er sjeldne, men 15–20 % utvikler senere substitusjonskrevende hypopituitarisme. Norske erfaringer samsvarer med dette (35-37).
Hjernemetastaser
Hjernemetastaser forekommer hos 20–30 % av pasienter med systemisk kreft og er den vanligste formen for «hjernesvulst» hos voksne (38, 39). De fleste stammer fra lunge-, bryst- eller melanomsykdom, men forekomsten endres med nye systemiske behandlinger og økt overlevelse. Helhjernebestråling (WBRT) var tidligere standardbehandling, men risiko for kognitiv svikt og manglende overlevelsesgevinst har ført til et skifte mot mer målrettede og vevssparende metoder (40-46).
Pasienter med metastaser som gir masseeffekt eller krever histologisk verifisering, bør vurderes for kirurgisk reseksjon (43, 46). Kirurgi kombineres ofte med postoperativ strålebehandling mot reseksjonshulen for å redusere residivrisiko, og bruken av helhjernebestråling er avtakende (42). Flere kreftformer har nå systemiske medikamenter med dokumentert intracerebral effekt, for eksempel annet EGFR- eller ALK-mutert lungekreft, HER2-positiv brystkreft, BRAF-mutert melanom og PD-L1-positiv lungekreft. Slik målrettet behandling og immunterapi kan gi langvarig kontroll og i enkelte tilfeller erstatte eller utsette lokal strålebehandling ved asymptomatiske metastaser (43, 45, 46).
Amerikanske og europeiske retningslinjer anbefaler stereotaktisk strålebehandling fremfor helhjernebestråling hos pasienter med god funksjon (Karnofsky Performance Scale, KPS ≥ 70 eller Eastern Cooperative Oncology Group, ECOG ≤ 2) og begrenset intrakraniell sykdom (43, 46). De fleste studier inkluderer én til fire metastaser, men nyere data viser at opptil ti kan behandles trygt dersom samlet volum er under 15 ml (46, 47) (bilde 4). I praksis er derfor totalvolum viktigere enn antall lesjoner. Ved lavt metastasevolum og kontrollert ekstrakraniell sykdom oppnås høy lokal kontroll og bevart kognitiv funksjon.
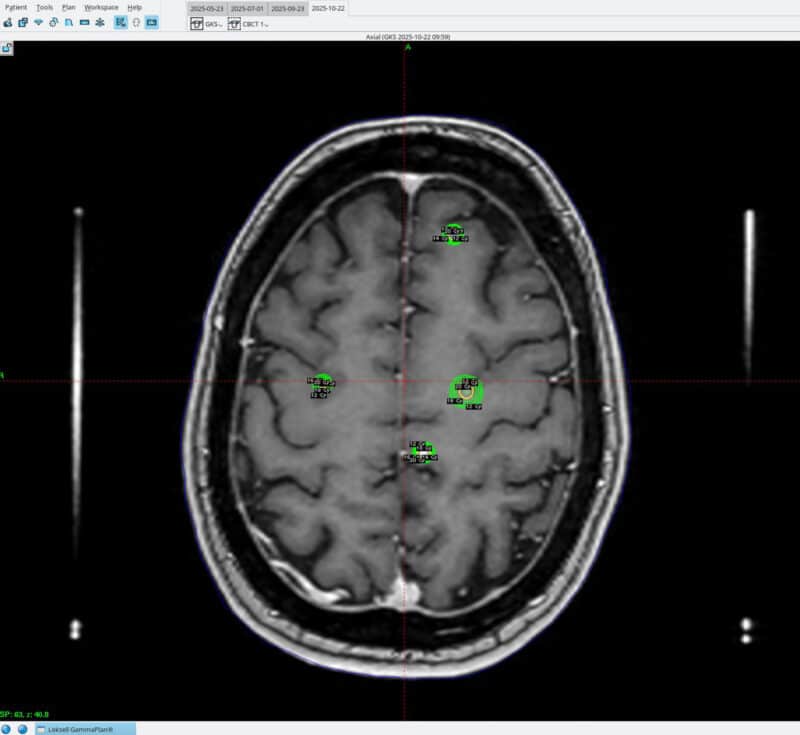
Bilde 4: Stråleknivbehandling av fire hjernemetastaser, illustrert med randdosen (20 Gy) og dosefallet i grønne linjer (18, 16, 14 og 12 Gy). Bildet er gjengitt med samtykke fra pasienten.
Strålekniven regnes fortsatt som den mest presise stereotaktiske metoden, men forskjellen til moderne linac-systemer er i dag hovedsakelig dosimetrisk og vist i laboratoriestudier, og ikke som klinisk forskjell i kontroll eller overlevelse (48-50).
Stereotaktisk behandling gir bratte dosegradienter som reduserer volumet av frisk hjerne som mottar 12 Gy eller mer (V12) – den viktigste prediktoren for symptomatisk radionekrose (51, 52). Typisk doseområde ved hjernemetastaser er 18–25 Gy, avhengig av volum, lokalisasjon og prognose. Det bratte dosefallet muliggjør trygg enkeltdosebehandling av flere små lesjoner uten overlappende felt, og stråleknivbehandling er særlig egnet ved multifokal, men lavvolumsykdom. Lokal kontroll ligger vanligvis mellom 85 og 95 %, avhengig av primærdiagnose og metastasestørrelse (43, 46). Vi har muligheten til å re-behandle, og MR-kontroller i etterkant er en del av «behandlingen».
Gliom
Gliomer utgjør en heterogen gruppe svulster som oppstår fra hjernens støtteceller – astrocytter, oligodendrocytter og ependymceller – og som varierer betydelig i veksthastighet, klinisk forløp og prognose. Felles for gliomene er en diffus, infiltrativ vekst som gjør radikal kirurgi umulig i mange tilfeller. Det kan derfor synes lite logisk at en diffus, vanskelig definerbar og infiltrativt voksende svulst skal behandles med høypresis, skarpt avgrenset strålebehandling – men likevel har stråleknivbehandling en rolle i gliombehandlingen.
Primærbehandlingen av gliomer er kirurgi. Den gir volumreduksjon, pasienten får en molekylærpatologisk diagnose med mulighet for persontilpasset behandling, det kan gi symptombedring og økt overlevelse (53). Avhengig av WHO-klassifikasjon og reseksjonsgrad behandles de fleste gliomer postoperativt med ekstern, fraksjonert stråling – typisk 1,8 Gy × 30 = 54 Gy. Til tross for standardiserte behandlingsprotokoller har svulstene høy residivrate (54). I residivsettingen er behandlingen mindre definert, og her har stereotaktisk strålebehandling en plass som selektivt tiltak ved små rest- eller residivlesjoner, der målet er lokal kontroll, symptomlindring og bevaring av funksjon uten skade på omkringliggende hjernevev. Den brukes særlig ved lokalt residiv etter kirurgi og ekstern stråling, eller ved restsvulst i funksjonelt viktige områder der ytterligere kirurgi ikke er ønskelig (55-58).
Vi behandler ofte hjernevev som nylig er bestrålt, og lesjonene er ofte store, noe som begrenser marginaldosen til 12–18 Gy ved enkeltfraksjon. Prognosen er best hos pasienter med god allmenntilstand (KPS > 60), alder under 70 år, små svulstvolum (< 10 cm³) og unifokal sykdom (6). Vanlige bivirkninger er forbigående ødem og hodepine. Radiologiske stråleforandringer sees hos 10–25 %, men er sjelden symptomatiske, og symptomatisk radionekrose forekommer i under 10 %, avhengig av dose og volum (57, 59).
Andre «svulstindikasjoner»
Vi har omtalt de vanligste svulstindikasjonene for stråleknivbehandling, men metoden kan også brukes ved flere sjeldnere svulster. Felles for disse er at de er velavgrensede (unntatt gliom), små (< 3 cm, < 10–15 cm³), har vekstpotensial og er vanskelig tilgjengelige for kirurgi. Stråleknivbehandling kan gis som primærbehandling, men brukes ofte ved rest- eller residivsvulst etter kirurgi. Eksempler er schwannom på andre hjernenerver enn n. vestibulocochlearis, craniopharyngeom, chordom, chondrosarkom, glomustumor, hemangiom, hemangioblastom, hemangiopericytom, sentralt nevrocytom, samt pineale og germinale svulster.
Perspektiv og fremtid
Etter snart 40 år i drift er strålekniven ved Haukeland fortsatt et sentralt verktøy i norsk nevrokirurgi. Metoden har vist sin verdi gjennom presisjon, sikkerhet og resultater – og gjennom sitt særpreg som et kirurgisk redskap i et felt dominert av onkologisk strålebehandling.
Referanser
1. Fodstad H, Hariz M, Ljunggren B. History of Clarke’s stereotactic instrument. Stereotact Funct Neurosurg. 1991;57(3):130-40.
2. Gildenberg PL. Spiegel and Wycis – the early years. Stereotact Funct Neurosurg. 2001;77(1-4):11-6.
3. Lasak JM, Gorecki JP. The history of stereotactic radiosurgery and radiotherapy. Otolaryngol Clin North Am. 2009;42(4):593-9.
4. Monaco EA, Grandhi R, Niranjan A, Lunsford LD. The past, present and future of Gamma Knife radiosurgery for brain tumors: the Pittsburgh experience. Expert Rev Neurother. 2012;12(4):437-45.
5. Schlesinger DJ, Yen CP, Lindquist C, Steiner L. Gamma Knife: Technical Aspects. In: Lozano AM, Gildenberg PL, Tasker RR, editors. Textbook of Stereotactic and Functional Neurosurgery. Berlin, Heidelberg: Springer Berlin Heidelberg; 2009. p. 897-928.
6. Niranjan A, Lunsford LD, Kano H. Leksell radiosurgery. Basel ; New York: Karger; 2019. xviii, 321 pages p.
7. Carlson ML, Habermann EB, Wagie AE, Driscoll CL, Van Gompel JJ, Jacob JT, Link MJ. The Changing Landscape of Vestibular Schwannoma Management in the United States–A Shift Toward Conservatism. Otolaryngol Head Neck Surg. 2015;153(3):440-6.
8. Taule EM, Dhayalan D, Berge JE, Goplen FK, Hess-Erga J, Lund-Johansen M, et al. Vestibularisschwannom – diagnostikk og behandling. Tidsskr Nor Laegeforen. 2025;145(5).
9. Carlson ML, Link MJ. Vestibular Schwannomas. N Engl J Med. 2021;384(14):1335-48.
10. Schnurman Z, Nakamura A, McQuinn MW, Golfinos JG, Roland JT, Kondziolka D. Volumetric growth rates of untreated vestibular schwannomas. J Neurosurg. 2020;133(3):742-8.
11. Dhayalan D, Tveiten OV, Finnkirk M, Storstein A, Hufthammer KO, Goplen FK, et al. Upfront Radiosurgery vs a Wait-and-Scan Approach for Small- or Medium-Sized Vestibular Schwannoma: The V-REX Randomized Clinical Trial. JAMA. 2023;330(5):421-31.
12. Tsao MN, Sahgal A, Xu W, De Salles A, Hayashi M, Levivier M, et al. Stereotactic radiosurgery for vestibular schwannoma: International Stereotactic Radiosurgery Society (ISRS) Practice Guideline. J Radiosurg SBRT. 2017;5(1):5-24.
13. Varughese JK, Wentzel-Larsen T, Pedersen PH, Mahesparan R, Lund-Johansen M. Gamma knife treatment of growing vestibular schwannoma in Norway: a prospective study. Int J Radiat Oncol Biol Phys. 2012;84(2):e161-6.
14. Tuleasca C, George M, Faouzi M, Schiappacasse L, Leroy HA, Zeverino M, et al. Acute clinical adverse radiation effects after Gamma Knife surgery for vestibular schwannomas. J Neurosurg. 2016;125(Suppl 1):73-82.
15. Helsedirektoratet. Meningeomer hos voksne – handlingsprogram, Nasjonal faglig retningslinje 2025 [Available from: https://www.helsedirektoratet.no/retningslinjer/meningeomer-hos-voksne-handlingsprogram.
16. Bloch O, Kaur G, Jian BJ, Parsa AT, Barani IJ. Stereotactic radiosurgery for benign meningiomas. J Neurooncol. 2012;107(1):13-20.
17. Goldman MJ, Teh BS, Lo SS, Butler EB, Baskin DS. Radiosurgery for Intracranial Meningiomas: A Review of Anatomical Challenges and an Update on the Evidence. Cancers (Basel). 2024;17(1).
18. Kondziolka D, Lunsford LD, Coffey RJ, Flickinger JC. Stereotactic radiosurgery of meningiomas. J Neurosurg. 1991;74(4):552-9.
19. Flickinger JC, Kondziolka D, Maitz AH, Lunsford LD. Gamma knife radiosurgery of imaging-diagnosed intracranial meningioma. Int J Radiat Oncol Biol Phys. 2003;56(3):801-6.
20. Kondziolka D, Mathieu D, Lunsford LD, Martin JJ, Madhok R, Niranjan A, Flickinger JC. Radiosurgery as definitive management of intracranial meningiomas. Neurosurgery. 2008;62(1):53-8; discussion 8-60.
21. Corniola MV, Roche PH, Bruneau M, Cavallo LM, Daniel RT, Messerer M, et al. Management of cavernous sinus meningiomas: Consensus statement on behalf of the EANS skull base section. Brain Spine. 2022;2:100864.
22. Marchetti M, Sahgal A, De Salles AAF, Levivier M, Ma L, Paddick I, et al. Stereotactic Radiosurgery for Intracranial Noncavernous Sinus Benign Meningioma: International Stereotactic Radiosurgery Society Systematic Review, Meta-Analysis and Practice Guideline. Neurosurgery. 2020;87(5):879-90.
23. Lee CC, Trifiletti DM, Sahgal A, DeSalles A, Fariselli L, Hayashi M, et al. Stereotactic Radiosurgery for Benign (World Health Organization Grade I) Cavernous Sinus Meningiomas-International Stereotactic Radiosurgery Society (ISRS) Practice Guideline: A Systematic Review. Neurosurgery. 2018;83(6):1128-42.
24. Santacroce A, Tuleasca C, Liscak R, Motti E, Lindquist C, Radatz M, et al. Stereotactic Radiosurgery for Benign Cavernous Sinus Meningiomas: A Multicentre Study and Review of the Literature. Cancers (Basel). 2022;14(16).
25. Goldbrunner R, Stavrinou P, Jenkinson MD, Sahm F, Mawrin C, Weber DC, et al. EANO guideline on the diagnosis and management of meningiomas. Neuro Oncol. 2021;23(11):1821-34.
26. Kaprealian T, Raleigh DR, Sneed PK, Nabavizadeh N, Nakamura JL, McDermott MW. Parameters influencing local control of meningiomas treated with radiosurgery. J Neurooncol. 2016;128(2):357-64.
27. Chen WC, Lucas CG, Magill ST, Rogers CL, Raleigh DR. Radiotherapy and radiosurgery for meningiomas. Neurooncol Adv. 2023;5(Suppl 1):i67-i83.
28. Pollock BE, Stafford SL, Link MJ, Garces YI, Foote RL. Single-fraction radiosurgery for presumed intracranial meningiomas: efficacy and complications from a 22-year experience. Int J Radiat Oncol Biol Phys. 2012;83(5):1414-8.
29. Skeie BS, Enger PO, Skeie GO, Thorsen F, Pedersen PH. Gamma knife surgery of meningiomas involving the cavernous sinus: long-term follow-up of 100 patients. Neurosurgery. 2010;66(4):661-8; discussion 8-9.
30. Caulley L, Quinn JG, Doyle MA, Alkherayf F, Metzendorf MI, Kilty S, Hunink MGM. Surgical and non-surgical interventions for primary and salvage treatment of growth hormone-secreting pituitary adenomas in adults. Cochrane Database Syst Rev. 2024;2(2):CD013561.
31. Rikvold SD, Pedersen MB, Andreassen M, Krogh J. Natural History of Non-Functioning Pituitary Adenomas: A Systematic Review and Meta-Analysis. Horm Metab Res. 2023;55(7):443-51.
32. Fleseriu M, Gurnell M, McCormack A, Fukuoka H, Glezer A, Langlois F, et al. Pituitary incidentaloma: a Pituitary Society international consensus guideline statement. Nat Rev Endocrinol. 2025;21(10):638-55.
33. Kotecha R, Sahgal A, Rubens M, De Salles A, Fariselli L, Pollock BE, et al. Stereotactic radiosurgery for non-functioning pituitary adenomas: meta-analysis and International Stereotactic Radiosurgery Society practice opinion. Neuro Oncol. 2020;22(3):318-32.
34. Mathieu D, Kotecha R, Sahgal A, De Salles A, Fariselli L, Pollock BE, et al. Stereotactic radiosurgery for secretory pituitary adenomas: systematic review and International Stereotactic Radiosurgery Society practice recommendations. J Neurosurg. 2022;136(3):801-12.
35. Lund-Johansen M, Aanderud S, Schreiner T, Bollerslev J, Bakke SJ, Johannesen O, et al. [Hormonally inactive pituitary adenomas]. Tidsskr Nor Laegeforen. 2003;123(16):2253-6.
36. Vik-Mo EO, Oksnes M, Pedersen PH, Wentzel-Larsen T, Rodahl E, Thorsen F, et al. Gamma knife stereotactic radiosurgery of Nelson syndrome. Eur J Endocrinol. 2009;160(2):143-8.
37. Vik-Mo EO, Oksnes M, Pedersen PH, Wentzel-Larsen T, Rodahl E, Thorsen F, et al. Gamma knife stereotactic radiosurgery for acromegaly. Eur J Endocrinol. 2007;157(3):255-63.
38. Achrol AS, Rennert RC, Anders C, Soffietti R, Ahluwalia MS, Nayak L, et al. Brain metastases. Nature Reviews Disease Primers. 2019;5(1):5.
39. Brenner AW, Patel AJ. Review of Current Principles of the Diagnosis and Management of Brain Metastases. Front Oncol. 2022;12:857622.
40. Lee YW, Cho HJ, Lee WH, Sonntag WE. Whole brain radiation-induced cognitive impairment: pathophysiological mechanisms and therapeutic targets. Biomol Ther (Seoul). 2012;20(4):357-70.
41. Brown PD, Jaeckle K, Ballman KV, Farace E, Cerhan JH, Anderson SK, et al. Effect of Radiosurgery Alone vs Radiosurgery With Whole Brain Radiation Therapy on Cognitive Function in Patients With 1 to 3 Brain Metastases: A Randomized Clinical Trial. JAMA. 2016;316(4):401-9.
42. Gondi V, Bauman G, Bradfield L, Burri SH, Cabrera AR, Cunningham DA, et al. Radiation Therapy for Brain Metastases: An ASTRO Clinical Practice Guideline. Pract Radiat Oncol. 2022;12(4):265-82.
43. Vogelbaum MA, Brown PD, Messersmith H, Brastianos PK, Burri S, Cahill D, et al. Treatment for Brain Metastases: ASCO-SNO-ASTRO Guideline. J Clin Oncol. 2022;40(5):492-516.
44. Grishchuk D, Dimitriadis A, Sahgal A, De Salles A, Fariselli L, Kotecha R, et al. ISRS Technical Guidelines for Stereotactic Radiosurgery: Treatment of Small Brain Metastases (</=1 cm in Diameter). Pract Radiat Oncol. 2023;13(3):183-94.
45. Mansouri A, Ozair A, Bhanja D, Wilding H, Mashiach E, Haque W, et al. Stereotactic radiosurgery for patients with brain metastases: current principles, expanding indications and opportunities for multidisciplinary care. Nat Rev Clin Oncol. 2025;22(5):327-47.
46. Le Rhun E, Guckenberger M, Smits M, Dummer R, Bachelot T, Sahm F, et al. EANO-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Ann Oncol. 2021;32(11):1332-47.
47. Bodensohn R, Maier SH, Belka C, Minniti G, Niyazi M. Stereotactic Radiosurgery of Multiple Brain Metastases: A Review of Treatment Techniques. Cancers (Basel). 2023;15(22).
48. Wang J, Zheng Q, Wang Y, Wang C, Xu S, Ju Z, et al. Dosimetric comparison of ZAP-X, Gamma Knife, and CyberKnife stereotactic radiosurgery for single brain metastasis. BMC Cancer. 2024;24(1):936.
49. Han EY, Wang H, Luo D, Li J, Wang X. Dosimetric comparison of fractionated radiosurgery plans using frameless Gamma Knife ICON and CyberKnife systems with linear accelerator-based radiosurgery plans for multiple large brain metastases. J Neurosurg. 2020;132(5):1473-9.
50. Calugaru E, Whiting Z, Delacruz B, Ma D, Garcia B, Goenka A, Chang J. Direct dosimetric comparison of linear accelerator vs. Gamma Knife fractionated stereotactic radiotherapy (fSRT) of large brain tumors. Med Dosim. 2023;48(1):31-6.
51. Bisello S, Cilla S, Benini A, Cardano R, Nguyen NP, Deodato F, et al. Dose-Volume Constraints fOr oRganS At risk In Radiotherapy (CORSAIR): An “All-in-One” Multicenter-Multidisciplinary Practical Summary. Curr Oncol. 2022;29(10):7021-50.
52. Milano MT, Grimm J, Niemierko A, Soltys SG, Moiseenko V, Redmond KJ, et al. Single- and Multifraction Stereotactic Radiosurgery Dose/Volume Tolerances of the Brain. Int J Radiat Oncol Biol Phys. 2021;110(1):68-86.
53. Weller M, Wen PY, Chang SM, Dirven L, Lim M, Monje M, Reifenberger G. Glioma. Nat Rev Dis Primers. 2024;10(1):33.
54. Kotecha R, Odia Y, Khosla AA, Ahluwalia MS. Key Clinical Principles in the Management of Glioblastoma. JCO Oncol Pract. 2023;19(4):180-9.
55. Pouratian N, Crowley RW, Sherman JH, Jagannathan J, Sheehan JP. Gamma Knife radiosurgery after radiation therapy as an adjunctive treatment for glioblastoma. J Neurooncol. 2009;94(3):409-18.
56. Skeie BS, Enger PO, Brogger J, Ganz JC, Thorsen F, Heggdal JI, Pedersen PH. gamma knife surgery versus reoperation for recurrent glioblastoma multiforme. World Neurosurg. 2012;78(6):658-69.
57. Kong DS, Lee JI, Park K, Kim JH, Lim DH, Nam DH. Efficacy of stereotactic radiosurgery as a salvage treatment for recurrent malignant gliomas. Cancer. 2008;112(9):2046-51.
58. Dodoo E, Huffmann B, Peredo I, Grinaker H, Sinclair G, Machinis T, et al. Increased survival using delayed gamma knife radiosurgery for recurrent high-grade glioma: a feasibility study. World Neurosurg. 2014;82(5):e623-32.
59. Park KJ, Kano H, Iyer A, Liu X, Niranjan A, Flickinger JC, et al. Salvage gamma knife stereotactic radiosurgery followed by bevacizumab for recurrent glioblastoma multiforme: a case-control study. J Neurooncol. 2012;107(2):323-33.