Katabolisme, akutt sykdom og IBD
Pasienter med IBD har ofte ernæringsutfordringer i kombinasjon med at sykdomsaktiviteten deres metabolsk setter dem i en katabol tilstand, der behandlere bør forstå de underliggende patofysiologiske mekanismene for å kunne gi optimalisert ernæring. Såvel sykdommen i seg selv som kirurgien fører til en inflammatorisk respons og neurohormonal aktivering som gir en multiorgan-insulinresistens (Figur 1) (5). Dette reduserer evnen til å forbrenne lett omsettelig glukose i muskulaturen, øker nedbrytning av proteiner til frie aminosyrer, og tømmer energilagrene i leveren ved å bryte ned blant annet glykogen og ved å produsere glukose fra andre substrater. Praktisk sett fører denne katabole tilstanden til et netto proteintap samtidig som for eksempel muskulatur ikke uten videre er mottagelig for å forbrenne for eksempel karbohydrater i like stor grad. Både tidspunkt, administrasjonsvei, varighet og opptrapping er avgjørende for å lykkes. Med disse patofysiologiske mekanismene i mente, så har behandlere en større forutsetning for å forstå for eksempel at ved feil bruk av parenteral ernæring (PN) klarer ikke pasienten å nyttiggjøre seg av energien og for mye kan potensielt være skadelig, mens for eksempel økt mengde av proteiner kan være anabolsk gunstig for pasienten.
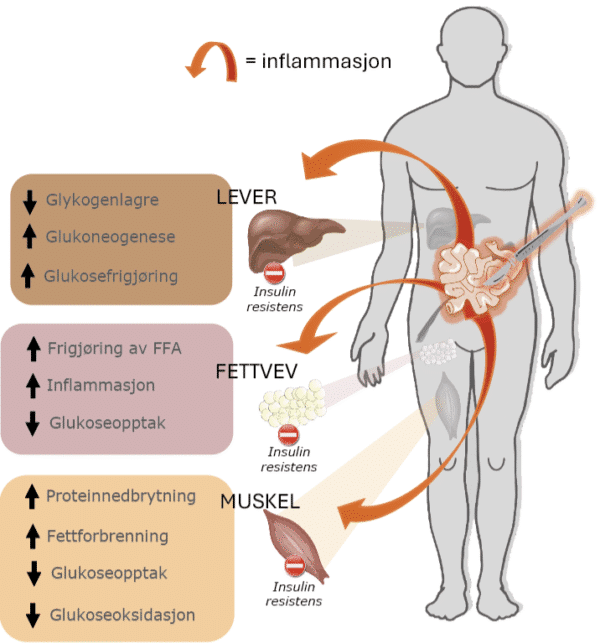
Figur 1: Kirurgi og inflammasjon fra syk tarm hos IBD-pasienter frigjør inflammasjonsmediatorer som gir en multiorgan-insulinresistens som er hovedkjennetegnet ved den katabole tilstanden til pasientene. Muskulatur reduserer forbrenningen av glukose og øker fettforbrenningen, mens proteiner brytes aktivt ned. Fettvev frigjør frie fettsyrer samt forsterker inflammasjonsresponsen. Leveren tømmer energilagrene og frigjør fritt glukose, hovedsakelig i form av nedbrytning av glykogen og øker egenproduksjonen av glukose gjennom glukoneogenese. (Figur laget av Martin Hagve)
Vurdering av underernæring hos IBD-pasienter
IBD-pasienter har ofte ernæringsutfordringer som både påvirker næringsopptak og -inntak, og risikoen for sykdomsrelatert feilernæring er stor, som regel på grunn av underernæring. Vi vet at underernæring blant annet gir økt risiko for komplikasjoner etter kirurgi, øker liggetid på sykehus og gir lavere livskvalitet (6,7). Det er derfor viktig å kartlegge om pasientene er i risiko for underernæring, særlig før kirurgi, og sette i gang tiltak tidlig for å øke næringstilførselen dersom det er nødvendig. Det brukes derfor screeningverktøy for å kartlegge risiko for underernæring, og pasienter med risiko skal ha en individuell ernæringsplan. Det finnes dog mange slike screeningverktøy uten at det er noen uniform faglig enighet eller evidens for det mest optimale verktøyet. Screeningverktøyene tar hensyn til forskjellige risikofaktorer relatert til underernæring som er vist å forverre utfallet for pasienten, der vekttap over tid trolig er den viktigste risikofaktoren (8). Andre faktorer som sykdomsaktivitet, appetitt, kvalme og BMI inngår ofte også. Albumin er ikke uvanlig brukt i klinisk praksis, og lav albumin i fravær av annen årsak (som leversvikt, nyresvikt eller alvorlig væskeimbalanse) kan riktignok indikere alvorlig underernæring (3). Likevel kan IBD-pasienter være underernært med normal albumin (>30 g/L), og albumin har heller ingen plass i vurderingen av om ernæringsintervensjon fungerer, slik at klinisk konsekvens av å vektlegge albumin er lav. Hvilke faktorer som er mest egnet for vurdering av underernæring og i hvilken kombinasjon, har ingen tydelig evidens eller enighet. IBD-pasienter i aktiv sykdomsfase er imidlertid svært katabole og ved rutinemessig screening bør et verktøy som inkluderer sykdomsaktivitet brukes. Internasjonalt er det anbefalt at alle pasienter med IBD jevnlig blir ernæringsscreenet uavhengig av sykdomsaktivitet og plan om kirurgisk behandling. I Norge anbefaler nå Helsedirektoratet verktøyet Malnutrition Screening Tool (MST) for alle pasienter. Ettersom MST blant annet ikke tar høyde for akutt sykdom, erfarer vi at mer omfattende screeningverktøy og ernæringskartlegginger er mer egnet for oppfølging av IBD-pasienter. Ved aktiv sykdom og særlig i forbindelse med kirurgi er korrekt vurdering av underernæring avgjørende, og da kan det stilles spørsmål om ernæringsscreening har en verdi eller plass i vurderingen i det hele tatt. IBD-pasientene er såpass sårbare for underernæring at det er gode argumenter for at alle pasienter planlagt for kirurgi bør få utarbeidet en individuell ernæringsplan i samråd med klinisk ernæringsfysiolog både før og etter inngrepet.
Ernæringsvei og strategi
Selv om underernæring er sterkt assosiert med dårligere utfall, er ikke evidensen for at en ernæringsintervensjon før kirurgi kan bedre utfallet like god. Det er heller ikke etablert hva som er mest optimale strategi, eller hvor lenge man eventuelt skal utsette kirurgi. For kirurgiske pasienter finnes ingen definitive randomiserte studier, dog en metaanalyse med over 1000 pasienter der de som fikk preoperativ ernæring (enteralt eller TPN) hadde en samlet komplikasjonsrate på 20 %, mot 60 % i gruppen som ikke fikk preoperativ ernæringsstøtte (9). Den typiske anbefalingen fra ESPEN og ECCO er at en preoperativ intervensjon bør vare minimum 10-14 dager. Anbefalingen bygger hovedsakelig på data for kreftpasienter der behovet for kirurgi kan være mer akutt, og IBD-pasienter er en pasientgruppe der man potensielt kan tillate seg å vente lenger med kirurgi. På bakgrunn av pasientens katabole tilstand vil ikke pasientene klare å bygge seg opp like raskt og dermed vil effekten av en ernæringsintervensjon sannsynligvis ta noe lengre tid. Det bør derfor vurderes seks til åtte uker med medisinsk ernæring om mulig, hvilket også støttes av retningslinjer (3,4).
Som for alle kirurgiske pasienter er oral og enteral tilgang, for eksempel med ernæringssonde, foretrukket så lenge det ikke foreligger kontraindikasjoner eller ulemper. Dette kan være for eksempel en høy og komplisert fistel, ileus, høy stomioutput eller ved buk-katastrofer/åpen buk der man anser at enteral ernæring (EN) forverrer tilstanden. Samtidig er tarmen selv et organ som i stor grad ernæres via eget opptak av EN og for IBD-pasienter kan den ernæringen tarmen mottar ha direkte effekt på å sette pasienten i en anabol tilstand. Dette kompliseres ved IBD da tarmen selv er utgangspunktet for sykdommen, men EN er likevel anbefalt. Bruk av total parenteral ernæring (PN) i det henseende av å gi tarmhvile for tilheling har vært en konsensus i tidligere tider, men har likevel lite evidens for å være fordelaktig for pasientene og er noe de fleste har gått bort fra i dag. Ved alvorlig underernæring er direkte oppstart med PN anbefalt under visse forutsetninger, også fremfor å avvente eventuell effekt av EN dersom det er usikkert om dette fører frem i påvente av kirurgi (2,3). Det er dog viktig å ikke tilføre pasienten for mye næring for fort, da den katabole tilstanden kan føre til at pasienten ikke klarer å nyttiggjøre seg av ernæringen, spesielt ved PN (5). Ved bruk av parenteral ernæring til alvorlig underernærte IBD-pasienter, er det viktig å kartlegge risiko for og forebygge reernæringssyndrom. Dette gjøres ved at elektrolytter, inkludert fosfat og magnesium bør monitorers jevnlig (og korrigeres), spesielt i oppstartsfasen. Det er viktig å være observant på at redusert opptak (som ved diaré) også utgjør en risiko i tillegg til vekttap, BMI og redusert matinntak.
Energibehovet kan være økt i aktiv sykdomsfase, men få studier har sett på pasientenes faktiske behov. IBD-pasientene kan ha høyre basal energiomsetning ettersom de er i katabol fase, men det er også sannsynlig at de har tilsvarende lavere aktivitetsnivå, slik at anbefalt energiinntak er derfor 100 % av utregnet behov, som ved bruk av prediktiv likning typisk regnes ut til 25-30 kcal/kg/døgn.
Det mest presise vil være å måle pasientene sitt energiforbruk i hvile med et indirekte kalorimeter, og dette anbefales i tilfeller der det er svært vanskelig å vurdere behov (3). Dette gjelder blant annet pasienter med veldig høy eller veldig lav kroppsvekt. Det er dog få i dag som har et slik instrument tilgjengelig i en klinisk hverdag, og i praksis bør man følge med på vektutvikling for å vurdere ernæringseffekt.
Ernæringssammensetning og spesifikke dietter
Ernæring er ikke bare viktig for å gi tilstrekkelig energi, men kan også være en del av behandlingen til pasienter med Crohns sykdom. Bruk av eksklusiv enteral ernæring (EEN) kan administreres med ulike protokoller, men er enkelt forklart ofte seks til åtte uker med inntak av kun flytende næring i form av næringsdrikker eller enteral ernæring. EEN har meget oppløftende vist å kunne indikere remisjon på lik linje med medikamentell behandling, spesielt hos barn, i tillegg til at man unngår negative bivirkninger av for eksempel steroider (10,11). Virkningsmekanismen bak EEN er sammensatt og ikke helt klarlagt, men er vist å ha positiv effekt på tarmens mikrobiom, bevare tarmens barriereintegritet og kan positivt påvirke inflammasjonsaktivering (10). Det er i dag anbefalt å bruke EEN som førstelinjeterapi til barn, men vi erfarer at det er lokale forskjeller på varigheten av dietten og om den kombineres med steroider eller ikke. Selv om seks til åtte uker er anbefalt, er det viktig å ta hensyn til hvert enkelt barn, da en streng diett over tid kan føre til forstyrret spiseatferd. EEN brukes derfor ofte i en kortere periode, før overgang til dietten Crohns Disease Exclusions Diet (CDED), med gradvis overgang fra flytende næring til normalt kosthold, med visse restriksjoner. Hos voksne er imidlertid EEN mindre brukt, men nylig oppdaterte ECCO retningslinjer anbefaler EEN også til voksne på bakgrunn av at noen studier nå har vist tilsvarende effekt som hos barn (10). Vi mener derfor at EEN burde få større oppmerksomhet hos behandlere av også voksne pasienter med Crohns sykdom i Norge. Det er fremdeles noe mangel på evidens og mange studier viser dårlig compliance. Det er derfor viktig at pasienten selv er motivert for gjennomføring av dietten og har tett oppfølging fra lege og klinisk ernæringsfysiolog som har bred erfaring med IBD og EEN underveis. For pasienter med ulcerøs kolitt er EEN og CDED ikke anbefalt.
For pasienter som ikke er i aktiv sykdomsfase anbefales et normalt, sunt kosthold i tråd med Helsedirektoratets kostråd, uten strenge restriksjoner. Likevel er det mange som reagerer på ulike matvarer med IBS-lignende symptomer, og derfor begrenser inntaket av disse (12,13). Ved IBS brukes ofte lavFODMAP-dietten, men ulike studier viser motstridende resultat på effekten av lavFODMAP til IBD-pasienter (13). Ved strenge kostrestriksjoner over tid, uten tilskudd, er det sannsynlig at inntaket av mikronæringstoffer blir for lavt, spesielt av kalsium og vitamin D, siden mange utelater meieriprodukt fra kostholdet (12). Behovet for tilskudd av kalsium og vitamin D styrkes ytterligere ved eventuell steroidbehandling. Vi støtter derfor ESPEN sin anbefaling om jevnlig oppfølging av mikronæringstoffer hos disse pasientene, spesielt de som har kostrestriksjoner og er under medikamentell behandling.
Økt inntak av essensielle aminosyrer kan være fordelaktig for å aktivere en mer anabol metabolisme. Dette, i tillegg til eventuell steroidbehandling og for å promotere tilheling etter kirurgi, gir grunnlag for å anbefale et høyt proteininntak til pasienter i aktiv sykdomsfase, spesielt før og etter kirurgi. Det er anbefalt 1,2-1,5 g/kg/dag i denne fasen, og 1 g/kg/dag for pasienter i remisjon (3). Det bør bemerkes at skal man oppnå et slikt proteinmål må man ha fokus på inntak av proteinrike matvarer til alle måltid og/eller proteintilskudd. Når det gjelder næringsdrikker og enteral ernæring bør høy-protein løsninger brukes, men det presiseres at også energibehovet må dekkes for å optimalisere anabolismen.
Tarmsvikt
Tarmsvikt er en diagnose som får lite oppmerksomhet, men er veldig alvorlig for dem det rammer. Tarmsvikt kan være funksjonell, men korttarmsyndrom står for 75 % av tilfellene (14). Tilstanden oppstår når det er en reduksjon i tarmfunksjon som fører til at minimumskravet for absorpsjon av næring, væske og elektrolytter ikke er opprettholdt, som i praksis ofte innebærer tynntarm kortere enn ca. 150-200 cm. Tidligere var Crohns sykdom den vanligste årsaken til korttarm-syndrom, men grunnet de store fremskrittene man har sett innenfor medisinsk behandling, utgjør de i dag kun ca. 20 % nye tilfeller. Likevel inkluderer porteføljene trolig flest pasienter med Crohns sykdom som grunnlidelse, da man ikke skal langt tilbake i tid der disse fikk mer omfattende kirurgisk behandling (14). De aller fleste av disse har tarmsvikt grunnet korttarmsyndrom, men noen har det grunnet persisterende tarmfistler.
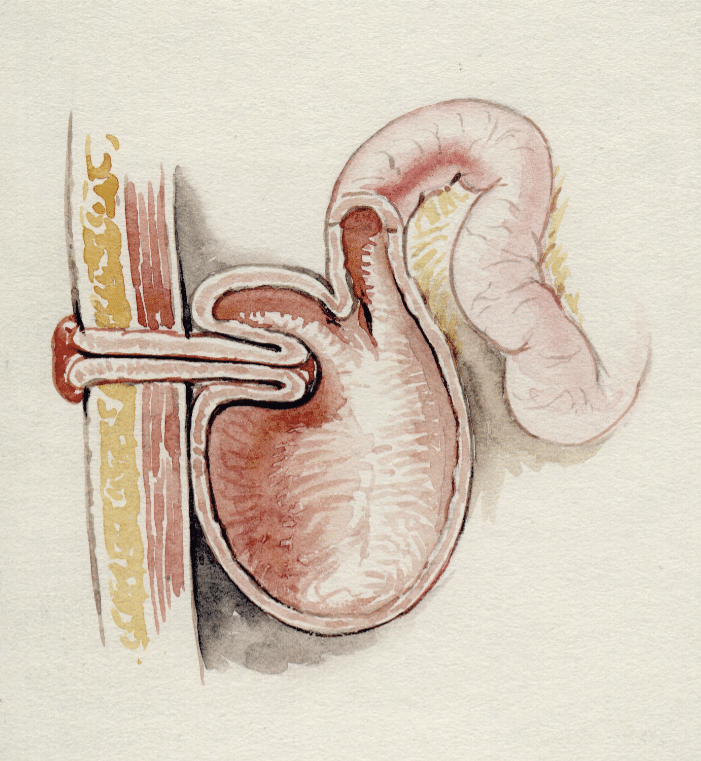
I land med større volum har disse pasientene blitt sentralisert til egne tarmsvikt-enheter. Med Norges lave volum, og utfordrende geografi er ikke dette opplagt en bærekraftig løsning, men selv om pasientgruppen er liten mener vi det er gunstig å ha et sentralisert tilbud i regionen med et dedikert team bestående av blant annet gastromedisiner, kirurg, ernæringsfysiolog og stomisykepleier for en helhetlig behandling. Vi har god erfaring med dette gjennom en dedikert tarmsvikt-poliklinikk og ser blant annet at Danmark i større grad har lykkes med et slikt helhetlig tilbud. Behandling innebærer tett oppfølging av elektrolytter og væskebalanse, optimalisering av kost og medisinsk ernæring, og håndtering av høy output-stomi. Utover vanlige tiltak her gir en slik poliklinikk for eksempel mulighet til å drive aktiv reintroduksjons-enteroklysebehandling. Dette innebærer å sette tarmens innhold fra et tilførende løp, tilbake i et fraførende løp (Figur 2). Dette kan være ved for eksempel en høy stomi eller ved en høy fistel, der tilførende løp har høy produksjon og innkoblet tarm har lite ernæringsopptak. Utfordringen ved enteroklyse er at det kreves høy motivasjon hos pasient og kan være betydelig ressurskrevende for helsepersonell ved langvarig behandling. Det finnes kommersielle pumper som automatisk kan pumpe innhold fra en stomipose til et kateter beliggende i fraførende løp som kan være aktuelt for pasienter med varig tarmsvikt, som har særlige utfordringer.
Figur 2: Reintroduksjons-enteroklyse gjøres ved at man setter innhold fra tilførende løp, gjerne fra stomiposen, tilbake til et fraførende løp eller en fraførende fistel via et kateter. Dette kan pasienten lære å gjøre selv, eller få hjelp til av helsepersonell. Enteroklyse settes både for at ernæring, væske og salter kan reabsorberes i utkoblet tarm, men stimulerer også tarmen til opprettholdelse av naturlig funksjon. Enteroklyse kan også brukes kortvarig i forkant av stomitilbakelegging for å gjenopprette tarmfunksjon i utkoblet løp. (Figur laget av Martin Hagve, med tillatelse fra pasienten)
For utvalgte pasienter med varig tarmsvikt og behov for PN, har behandling med GLP-2 analog vist å bedre ernæringsopptaket ved å blant annet stimulere vekst og morfologi av tarmtottene (Figur 3). I studier har behandling vist å redusere behovet for PN (15). Behandlingen er kostbar og dette må veies mot nytte for hver enkelt pasient. Medikamentell behandling er nylig godkjent i Beslutningsforum for pasienter med PN under visse kriterer, og vi ønsker å gjøre kollegaer oppmerksom på dette.
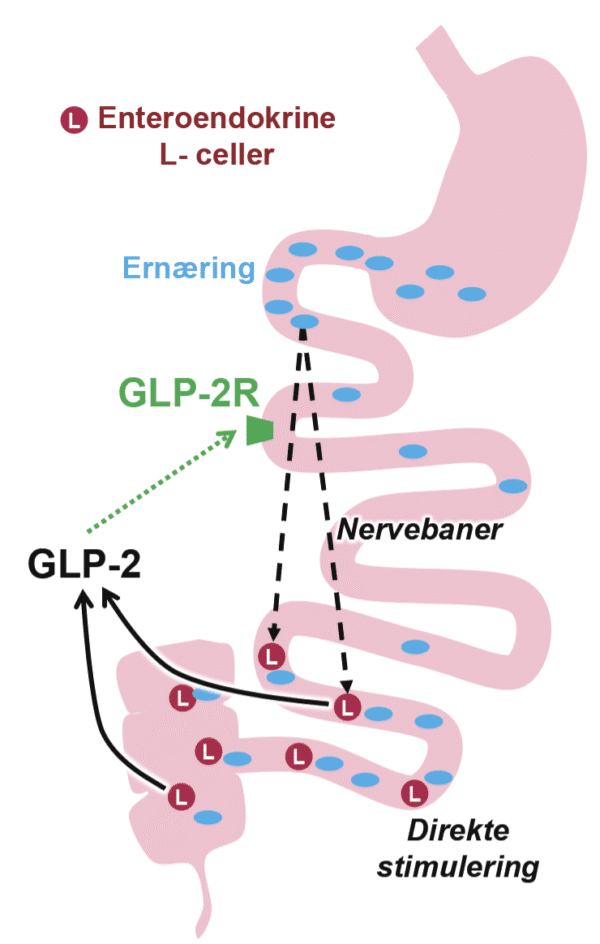
Figur 3: Glukagon-like peptide 2 (GLP-2) er et naturlig intestinalt hormon som produseres i enteroendocrine L-celler hovedsakelig i ileum. Ernæringsinntak stimulerer frigjøring og GLP-2 som så aktiverer GLP-2 reseptor og stimulerer vekst av tarmtotter, absorbsjonsevne, adaptasjon og har antiinflammatoriske egenskaper. GLP-2 analoger er godkjent behandling for korttarmsyndrom. (Figur av Takeda og modifisert av Hagve med tillatelse)
Prehabilitering og fysisk aktivitet
Utover optimalisering av ernæring anbefales det å redusere steroidbruk før kirurgi (16). Bruk av for eksempel biologisk behandling kan aksepteres, og studier viser at pågående biologisk behandling ikke øker sjansen for postoperativ komplikasjon (16). Tett samarbeid med gastroenterologer er viktig her. Tiltak som røykeslutt og jerntilskudd er detaljer som er viktige for alle kirurgiske pasienter, men for en IBD-pasient er alle optimaliseringer avgjørende for et vellykket kirurgisk utfall og etablering av tarmkontinuitet. Prehabilitering med fysisk trening burde være et åpenbart tiltak for å bedre utfallet for kirurgiske pasienter generelt, men vi erfarer at det er først nylig at det har blitt et reelt klinisk fokus på dette i Norge. Oss bekjent finnes det heller ingen studier som kan vise til dette hos IBD pasienter, hverken i det hensende bedre remisjon eller som prehabilitering for kirurgi, men det pågår randomiserte studier og vi tror viktigheten av prehabilitering med fysisk aktivitet for kirurgiske pasienter og IBD-pasienter vil bli langt mer fokusert på i fremtiden.
Referanser
1. Selin KA, Andersson S, Bilén K, Strid H, Björk J, Soop M, et al. Variation in nutritional therapy practices: results of a survey on nutritional management of severe inflammatory bowel disease. Eur J Gastroenterol Hepatol. 2025;37(2):167–75.
2. Forbes A, Escher J, Hébuterne X, Kłęk S, Krznaric Z, Schneider S, et al. ESPEN guideline: Clinical nutrition in inflammatory bowel disease. Clin Nutr. 2017;36(2):321–47.
3. Bischoff SC, Escher J, Hébuterne X, Kłęk S, Krznaric Z, Schneider S, et al. ESPEN practical guideline: Clinical Nutrition in inflammatory bowel disease. Clin Nutr. 2020;39(3):632–53.
4. Svolos V, Gordon H, Lomer MCE, Aloi M, Bancil A, Day AS, et al. ECCO Consensus on Dietary Management of Inflammatory Bowel Disease. J Crohn’s Colitis. 2025;jjaf122.
5. Hagve M, Gjessing P, Ytrebø LM, Irtun Ø. Ernæring hos kritisk syke intensivpasienter. Tidsskr Den Nor legeforening. 2020;140(2).
6. Maia F de CP, Silva TA, Generoso S de V, Correia MITD. Malnutrition is associated with poor health-related quality of life in surgical patients with gastrointestinal cancer. Nutrition. 2020;75:110769.
7. Williams DGA, Molinger J, Wischmeyer PE. The malnourished surgery patient: a silent epidemic in perioperative outcomes? Curr Opin Anaesthesiol. 2019;32(3):405–11.
8. Skeie E, Tangvik RJ, Nymo LS, Harthug S, Lassen K, Viste A. Weight loss and BMI criteria in GLIM’s definition of malnutrition is associated with postoperative complications following abdominal resections – Results from a National Quality Registry. Clin Nutr. 2020;39(5):1593–9.
9. Brennan GT, Ha I, Hogan C, Nguyen E, Jamal MM, Bechtold ML, et al. Does preoperative enteral or parenteral nutrition reduce postoperative complications in Crohn’s disease patients. Eur J Gastroenterol Hepatol. 2018;30(9):997–1002.
10. Boneh RS, Westoby C, Oseran I, Sarbagili-Shabat C, Albenberg LG, Lionetti P, et al. The Crohn’s Disease Exclusion Diet: A Comprehensive Review of Evidence, Implementation Strategies, Practical Guidance, and Future Directions. Inflamm Bowel Dis. 2023;30(10):1888–902.
11. Narula N, Dhillon A, Zhang D, Sherlock ME, Tondeur M, Zachos M. Enteral nutritional therapy for induction of remission in Crohn’s disease. Cochrane Database Syst Rev. 2018;2018(4):CD000542.
12. Larussa T, Suraci E, Marasco R, Imeneo M, Abenavoli L, Luzza F. Self-Prescribed Dietary Restrictions are Common in Inflammatory Bowel Disease Patients and Are Associated with Low Bone Mineralization. Medicina. 2019;55(8):507.
13. Fairbrass KM, Costantino SJ, Gracie DJ, Ford AC. Prevalence of irritable bowel syndrome-type symptoms in patients with inflammatory bowel disease in remission: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2020;5(12):1053–62.
14. Pironi L, Konrad D, Brandt C, Joly F, Wanten G, Agostini F, et al. Clinical classification of adult patients with chronic intestinal failure due to benign disease: An international multicenter cross-sectional survey. Clin Nutr. 2018;37(2):728–38.
15. Jeppesen PB, Pertkiewicz M, Messing B, Iyer K, Seidner DL, O’keefe SJD, et al. Teduglutide Reduces Need for Parenteral Support Among Patients With Short Bowel Syndrome With Intestinal Failure. Gastroenterology. 2012;143(6):1473-1481.e3.
16. Adamina M, Minozzi S, Warusavitarne J, Buskens CJ, Chaparro M, Verstockt B, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Surgical Treatment. J Crohn’s Colitis. 2024;18(10):1556–82.