Små anatomiske strukturer kan til tross for størrelse ha stor innvirkning på menneskelig helse. Paratyreoideakjertlene (biskjoldkjertlene) er et klassisk eksempel på dette paradokset. I denne artikkelen ser vi på paratyreoidea sin rolle i reguleringen av kalsium i kroppen og hvordan ulike former for hyperparatyreoidisme behandles kirurgisk.
Anatomi og fysiologi
Trolig på grunn av størrelsen ble paratyreoidea oppdaget sent i den medisinske historie. Først i 1880 ble paratyreoidea beskrevet i en publikasjon av den svenske anatomist og medisinstudent Ivar Sandström i Uppsala. Dette ble omtalt som oppdagelsen av «det siste anatomiske organ», men fikk liten internasjonal oppmerksomhet, da forfatteren kun fikk publisert artikkelen på sitt eget morsmål. Sandstrøm beskrev en liten blek kjertel «knapt så stor som et hampefrø» lokalisert ved skjoldbruskkjertelen (Figur 1) (1).
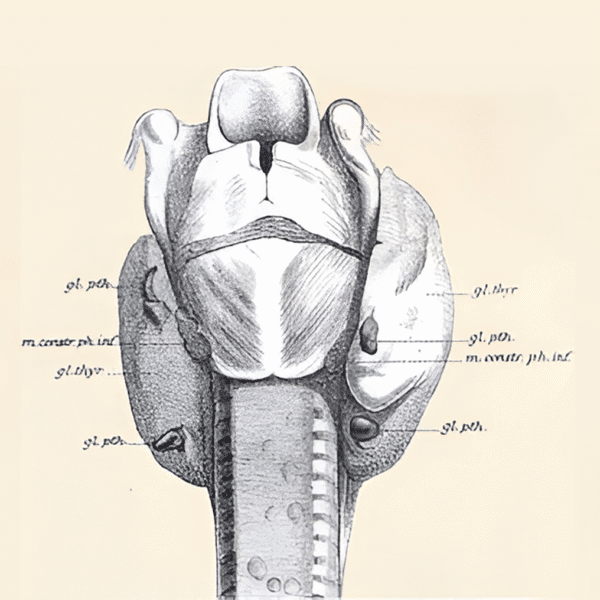
Figur 1: Sandströms tegning av paratyroideakjertlenes anatomi (fra Upsala Journal of Medical Sciences. 2015; 120: 72–77, Open Access)
I tiårene etter oppdagelsen erfarte en at ved å fjerne disse små kjertlene hos forsøksdyr kunne en utløse alvorlige kramper (tetani). Det var likevel først i 1925 at en gjennomførte første operasjon hos menneske med fjerning av en forstørret paratyreoidea. Denne ble gjennomført i lokalanestesi av Felix Mandl i Wien hos en 38 år gammel mann med alvorlig bensykdom (osteitis fibrosa cystica) og etter å ha fjernet en forstørret kjertel oppnådde en dramatisk bedring i skjelettstatus (2).
I årene etter andre verdenskrig ble det vanligere å behandle pasienter med primær hyperparatyreoidisme (pHPT) operativt og både utredning og behandling ble etter hvert systematisert.
Anatomisk kartlegging konkluderte etter hvert med at det hos mennesker og de fleste dyrearter finnes fire paratyreoideakjertler i nær relasjon til tyreoidea, og at normale kjertler kun måler 4-6 mm med vekt 20-40 mg. Hos noen kan det (tidvis til kirurgers frustrasjon) foreligge en femte kjertel og en sjelden gang flere. Embryologisk stammer de øvre paratyreoideakjertlene fra fjerde gjellebue og de nedre fra tredje gjellebue (sammen med tymus). Vanlig lokalisasjon er på hals, men som kirurger opp gjennom årene har erfart, kan lokalisasjon variere en del og kan gjenfinnes også i mediastinum (Bilde 1-3).
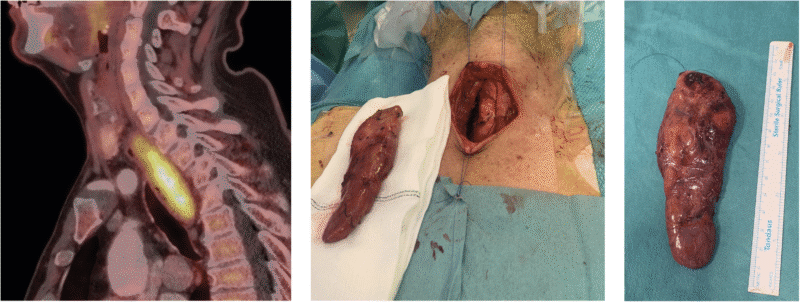
Bilde 1, 2 og 3: 18FCholin PET-undersøkelse og operasjonspreparat av et stort paratyroideaadenom (54 g) beliggende retroøsofagealt med ekstensjon ned i mediastinum. Sykdommen ble påvist på grunn av hyperkalsemisk krise. Pasienten har samtykket til bruk av bilder.
Paratyreoideahormon (PTH) utskilles fra hovedcellene (chief cells) i kjertlene som respons på fall i serumkalsium. Regulering skjer via kalsium-sensitive reseptorer (CaSR) på celleoverflaten, som monitorerer ekstracellulært kalsiumnivå og øker utskillelsen ved fallende kalsiumnivå. PTH regulerer kalsium via målorganer (skjelett og nyrer) for å oppnå homeostase. I nyrene økes den tubulære reabsorbsjon av kalsium. Dette skjer parallelt med at en får økt tap av fosfat i urinen, som følge av redusert tubulær reabsorbsjon av fosfat. Hos friske individer er det lite tap av kalsium fra ben i det daglige. Nyrene filtrerer opptil 10 000 mg kalsium hver dag, men 98 % blir reabsorbert. Utskillelse av kalsium i urin reflekterer i hovedsak netto absorbsjon fra tarm. I nyrene stimulerer PTH i tillegg til omdanning av vitamin D til aktive metabolitter som øker kalsiumopptak i tarm (Figur 2).
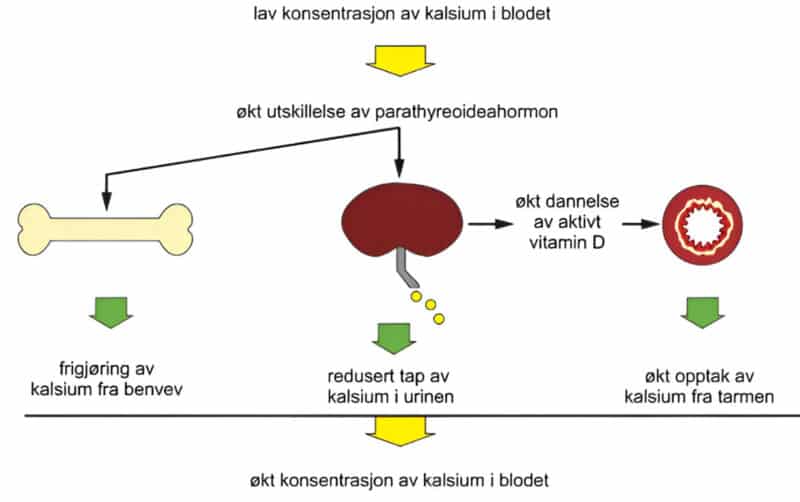
Figur 2: Kalsiummetabolismen (Halse, Johan; Berg, Jens Petter: parathyreoideahormon i Store medisinske leksikon på snl.no. Hentet 23. april 2025 fra https://sml.snl.no/parathyreoideahormon)
Paratyreoideakjertlene imponerer ikke i størrelse, men utgjør termostaten for regulering av kroppens kalsiumnivå. Denne reguleringen er kritisk for funksjonen til nerver, muskler og hjerte, i tillegg til koagulasjonssystemet.
Primær hyperparatyreoidisme
I den vestlige verden diagnostiseres primær hyperparatyreoidisme (pHPT) hos 0,7 % av befolkningen og 2 % av postmenopausale kvinner (3). 85-90 % har paratyreoideaadenom/enkjertelsykdom, 10-15 % har flerkjertelsykdom, mens cancer er svært sjelden (< 1 %). I dag er den vanligste årsaken til at pHPT blir oppdaget at pasienten får påvist forhøyet kalsium i serum uten at det på forhånd var mistanke om sykdommen. Andre årsaker kan være utredning på grunn av lavenergibrudd, påvist nedsatt bentetthet eller at pasienten har nyresteinsplager. Hos de fleste er imidlertid sykdommen asymptomatisk. Kurativ behandling er kirurgi, og det er dokumentert at operasjon kan bedre osteoporose, redusere nye nyresteinsanfall og stabilisere en eventuelt synkende nyrefunksjon (4).
Diagnostikk av pHPT
Diagnosen stilles ved påvist forhøyet kalsium med en samtidig PTH-verdi som er forhøyet eller uforholdsmessig høy i forhold til kalsiumverdien. Tiazider bør seponeres minst en uke før blodprøvetaking. Eventuell nyresvikt bør utelukkes ved måling av kreatinin og GFR og sekundær hyperparatyreoidisme, på grunn av D-vitaminmangel, utelukkes ved å konstatere at 25-OH-vitamin D >75 nmol/l.
En viktig, men sjelden differensialdiagnose til pHPT er familiær hypokalsiurisk hyperkalsemi (FHH), en autosomalt arvelig tilstand der kalsium og PTH kan være lett til moderat forhøyet. Kirurgi er ikke indisert for denne tilstanden som, i motsetning til pHPT, gir lav utskillelse av kalsium i urin. Ifølge internasjonale retningslinjer bør man før operasjon for hyperparatyreoidisme utelukke denne tilstanden ved utregning av kalsium-kreatinin-clearance-ratio (CCCR) ved målinger av kalsium og kreatinin i døgnurin og samtidig blodprøve. Endokrinologisk veileder anbefaler at man for enkelhets skyld starter med å regne ut kalsiumekskresjonsratio etter målinger i dagens andre morgenurin, selv om dette har lavere sensitivitet og spesifisitet (5). Ved usikkerhet om det kan foreligge FHH, kan man supplere med CCCR eller gå videre med gentest.
Ved påvist primær hyperparatyreoidisme utredes pasienten med DXA-scan for å utelukke osteoporose (påvises hos 50-60 %) med samtidig VFA (Vertebral Fracture Assessment) for å utelukke kompresjonsfrakturer i ryggen (hos ca. 1/3) og utredning med UL eller CT av nyrer for å utelukke nyrestein (15-20 %) eller nefrokalsinose (6).
Familieanamnese med tanke på hyperkalsemi, hyperparatyreoidisme eller nevroendokrine tilstander hører også med i det 2-5 % av pHPT har genetisk årsak (7). Flerkjertelsykdom eller hyperparatyreoidisme i ung alder gir økt mistanke om arvelig bakgrunn for sykdommen. Ved mistanke om familiær sykdom bør det foreligge svar på genpanel for hyperparatyreoidisme preoperativt, da dette kan ha betydning for operasjonsstrategien. Man bør også spørre om pasienten er operert med gastrisk bypass eller har andre malabsorbsjonstilstander, da disse pasientene kan være vanskelige å behandle dersom de får postoperativ hypokalsemi. Bruk av Litium eller benresorbsjonshemmere kan også komplisere diagnostikken.
Det kan også være nyttig med måling av magnesium, fosfat og alkalisk fosfatase preoperativt, spesielt ved alvorlig hyperkalsemi. Forhøyet ALP kan indikere økt fare for «hungry bone syndrom» (benhunger) med risiko for lave kalsiumverdier postoperativt.
Ved symptomatisk pHPT er det indikasjon for operasjon dersom det ikke foreligger sterk medisinsk kontraindikasjon eller pasienten etter informasjon ikke ønsker operasjon. Ved asymptomatisk sykdom er det også indikasjon for operasjon, dersom kriteriene i Tabell 1 er oppfylt. Endokrinologisk veileder anbefaler som nevnt kalsiumekskresjonsratio i spoturin i første omgang og har fritt kalsium i serum > 0,12 mmol/ l over øvre referansegrense som eget tilleggskriterium (5). Internasjonale retningslinjer finner også indikasjon for kirurgi hos pasienter med påvist asymptomatisk pHPT der videre medisinsk overvåkning som alternativ til operasjon av forskjellig grunner ikke er mulig eller der pasienten etter informasjon ønsker operasjon (4,8).

Tabell 1: Anbefalinger for kirurgisk behandling av asymptomatisk pHPT, (fra Bilezikian JP, Khan AA, Silverberg SJ et al. Evaluation and Management of Primary Hyperparathyroidism: Summary Statement and Guidelines from the Fifth International Workshop. JBMR 2022; 37(11): 2293-2314, Open Access)
Preoperativ billeddiagnostikk
– anatomisk kartlegging
Når det er funnet indikasjon for operasjon, henvises pasienten til billeddiagnostikk med tanke på å lokalisere den eller de patologiske paratyreoideakjertlene. Det vanligste har de siste årene vært å gjøre sestamibi-scintigrafi kombinert med SPECT/CT med en deteksjonsrate på 88 % i en metaanalyse (9). Problemet er betydelig lavere deteksjonsrate ved multiglandulær sykdom enn ved et adenom.
4D-CT, der den fjerde dimensjonen er tid for oppladning og utskillelse av kontrast i paratyreoideakjertelen, kan også være svært nyttig i den preoperative lokaliseringen, spesielt ved ektopisk lokalisasjon, og gir den beste fremstillingen av akkurat hvor patologien ligger i forhold til omgivende anatomiske strukturer. 4D-CT er bedre enn sestamibi med SPECT/CT, der det er behov for å reoperere pasienten for persisterende sykdom (10).
De siste par årene har vi fått et enda bedre nukleærmedisinsk lokaliseringsverktøy i 18FCholin PET/CT med en deteksjonsrate på minst 92 % (9). Dette brukes ved usikre funn på sestamibi-scintigrafi, og ved mange sentra er 18FCholinPET nå den foretrukne undersøkelsen (Bilde 1, 4 og 5).
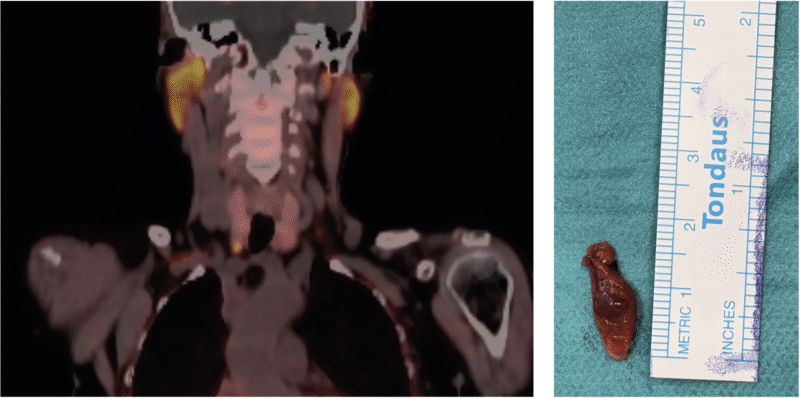
Bilde 4 og 5: 18FCholin PET-undersøkelse og operasjonspreparat av et mindre paratyroideaadenom ved nedre pol av høyre tyroidealapp. Sykdommen ble påvist i forbindelse med utredning av osteoporose. Pasienten har samtykket til bruk av bilder.
Nukleærmedisinske undersøkelser, alternativt 4D-CT, kombineres så med ultralydundersøkelse av halsen, der man ved et adenom gjerne ser en velavgrenset hypoekkoisk lesjon og da gjerne på et av predileksjonsstedene for paratyreoideakjertlene (Bilde 6). Sensitiviteten er svært avhengig av undersøker, men var i en metaanalyse 76 % med en positiv prediktiv verdi på 93 % (9). Det er en stor fordel om operatør har erfaring med ultralyd og selv gjør ultralyd preoperativt. Uansett bør operatøren selv granske det som foreligger av billeddiagnostikk før operasjonen for å danne seg et tredimensjonalt bilde av hvor patologien ligger. Ved konkordanse mellom to forskjellige billeddiagnostiske metoder, er det stor sannsynlighet for at det foreligger et enkelt adenom (>96 %) og det ligger til rette for en fokusert operasjon med stor sannsynlighet for at pasienten blir kurert.
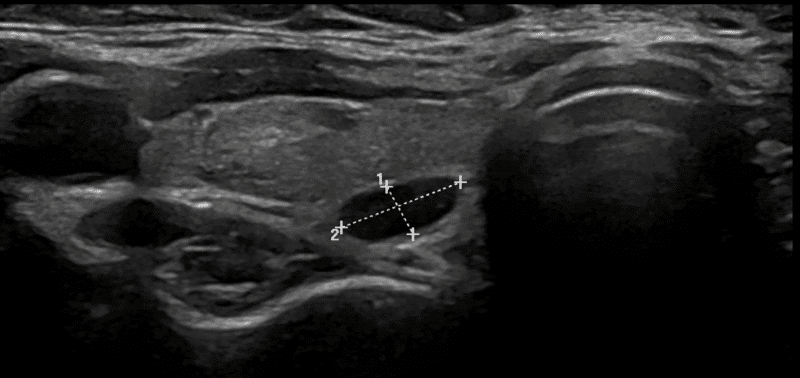
Bilde 6: UL-bilde av paratyroideaadenom bak nedre pol av høyre tyroidealapp. Pasienten har samtykket til bruk av bilde.
Hvis det ikke er konkordante funn eller man ikke ser noe ved undersøkelsene, kan dette skyldes at den forstørrede kjertelen kun er lett forstørret eller at det foreligger multiglandulær sykdom (10-15 %) og man må da ta høyde for at det må gjøres bilateral eksplorasjon. En erfaren endokrinkirurg må da være en del av operasjonsteamet.
Kirurgisk behandling
– eksplorasjon versus fokusert kirurgi
Bilateral halseksplorasjon med eksplorering og visualisering av alle fire paratyreoideakjertler er fortsatt gullstandarden i paratyreoideakirurgien som alle andre metoder vurderes opp mot. De fleste vil imidlertid i dag gjøre en eller annen form for målrettet operasjon dersom to billeddiagnostiske metoder viser én forstørret paratyreoideakjertel med samsvarende lokalisasjon. Dette kan gjøres som en målrettet operasjon via et lite Kochersnitt, det vil si et lett buet tverrsnitt litt ovenfor jugulum, eller det kan gjøres som en mini-invasiv paratyreoidektomi gjennom et ca. to cm langt snitt mellom laterale kant av rette halsmuskel og mediale kant av musculus sternocleidomastoideus ved en antatt forstørret øvre paratyreoideakjertel eller alternativt i midtlinjen ved en forstørret nedre kjertel. Det er en fordel at operatøren selv gjør ultralyd og merker av lokalisasjon til paratyreoideakjertelen i hud før oppstart av operasjonen. Ved større sentra med stort operasjonsvolum er den såkalte MIVAP-teknikken (minimalt invasiv video-assistert paratyreoidektomi), der man legger et halvannet cm langt snitt nedad i midtlinjen og dissekerer, veiledet av sanntidsvideobilder fra et endoskop som brukes som et “øye” i snittåpningen, en meget elegant og rask metode (11).
Intraoperativ PTH-måling anses av mange som en nødvendighet dersom man velger å utføre målrettet operasjon framfor bilateral halseksplorasjon. PTH har meget rask halveringstid i blod (3-5 min) og en protokoll hvor man anser > 50 % fall i PTH målt i blodprøve tatt 10 minutter etter eksisjon vil gi en positiv prediktiv verdi for biokjemisk kurasjon på >96 % (12).
Ved bruk av intraoperativ PTH-måling kan man også med mer usikre funn ved billeddiagnostikken, velge en mer begrenset operasjonsstrategi, selv om risikoen for multiglandulær sykdom er økt. Det kan noen ganger være aktuelt å starte med en ensidig halseksplorasjon der man vurderer begge paratyreoidakjertlene og hvis kun en anses «syk», kan denne fjernes, og man kan så benytte intraoperativ PTH-måling. Ved tilfredsstillende fall, kan operasjonen avsluttes. Gevinsten er at man unngår bilateral eksplorasjon, slik at kun en recurrensnerve utsettes for risiko for parese med heshet som følge, og faren for vedvarende hypoparatyreoidisme er svært liten. Ved planlegging av slik kirurgi bør man legge første incisjonen slik at denne kan forlenges til et Kochersnitt dersom det blir behov for full eksplorasjon.
Ved alle disse målrettede operasjonene er det den preoperative billeddiagnostikken som lokaliserer sykdommen og den intraoperative PTH-målingen som forteller operatøren om pasienten er biokjemisk kurert.
Hvis man ikke får tilfredsstillende fall i PTH peroperativt, må man gå videre og gjøre bilateral halseksplorasjon, der man lokaliserer alle fire kjertler og vurderer disse. Dersom alle er patologiske, må man gjøre subtotal paratyreoidektomi der man fjerner tre eller tre og en halv kjertel. Man bevarer hele eller en del som svarer til en normalt stor paratyreoidea av den mest normalt utseende kjertelen. Operatør tar også med i vurderingen at den bevarte kjertelen blir liggende slik til at det skal være mulig å reoperere pasienten ved et eventuelt residiv uten alt for stor komplikasjonsrisiko.
Tertiær hyperparatyreoidisme
Patofysiologi
Reguleringen av kalsium- og fosfathomeostasen er et innviklet, men nøye regulert samspill mellom nyrer, paratyreoideakjertler, skjelett og tarm. Ved redusert nyrefunksjon på grunn av kronisk nyresvikt utløses en rekke biokjemiske prosesser i disse organsystemene. Man betegner tilstanden som «chronic kidney disease – mineral and bone disease» (CKD-MBD). Når GFR faller til under 45, kan man se økende PTH-verdier, og pasienten har utviklet en sekundær renal hyperparatyreoidisme. Hvis nyrefunksjonen blir så dårlig at det er behov for dialyse, har så å si alle pasienter forhøyet PTH og mer enn 80 % har PTH > 16 (13). I starten er disse prosessene hensiktsmessige for å forsøke å opprettholde homeostasen og også påvirkelige av medikamentell behandling. Kalsium og fosfat kan derfor ofte ha normale verdier helt ned til en GFR på 20. Når pasienten har nådd kronisk nyresvikt i endestadiet (GFR< 15) med behov for dialyse, kan hen etter hvert utvikle refraktær renal hyperparatyreoidisme, som ikke lenger er påvirkelig av medikamentell behandling (med fosfatbindere, aktive D-vitamin analoger eller kalsimimetika). De har utviklet tertiær hyperparatyreoidisme (tHPT). tHPT kjennetegnes av at det ikke lenger er en polyklonal diffus hyperplasi av paratyreoidakjertlene – den langvarige overstimuleringen har gitt en monoklonal nodulær hyperplasi med blant annet redusert antall CaSR (kalsium-sensitive reseptorer) og VDR (vitamin D reseptorer) i paratyroideakjertlene. I motsetning til ved den sekundære fasen av renal HPT, der man gjerne finner lav eller normal kalsiumverdi, har man ved tHPT, som ved pHPT, både forhøyet kalsium og PTH. Fosfat er imidlertid også høy, mens den ved pHPT gjerne er rundt nedre referansegrense.
Ved tHPT ser man gjerne først symptomer ved PTH-verdier > 100 pmol/l. Dette kan dreie seg om kløe, proksimal muskelsvakhet og smerter i vektbærende ledd og knokler. Man kan også få bløtvevskalsifikasjoner og da gjerne i kar og en sjelden gang ser man kalsifylaksi eller «brun tumor» i skjelett.
Effekter av paratyreoidektomi
Hos de som har gått i dialyse i 10 år er det nødvendig med paratyreoidektomi hos ca. 15 % og etter 20 år hos 38 % (14).
Vellykket paratyreoidektomi medfører oftest at mange av symptomene forsvinner (hos 95 % i en studie), bentettheten øker, frakturrisikoen reduseres (med 31 %) og helserelatert livskvalitet bedres (15). Noen studier har også vist bedret ernæringsstatus og mindre resistens mot erytropoietinbehandling av anemi (16). Ifølge en metaanalyse med mer enn 22 000 pasienter der 10 000 var paratyreoidektomert, var det 37 % redusert kardiovaskulær mortalitet og 28 % redusert mortalitet uansett årsak blant de opererte (17).
I en studie utgående fra en stor amerikansk database over nyrepasienter som ble paratyreoidektomert i perioden 2007-2009 var det økt mortalitet de første 30 dagene postoperativt (2,0 %) og så mange som en fjerdedel ble reinnlagt første 30 dager (18). Disse pasientene som ofte er reduserte i utgangspunktet, er svært utsatt for hypokalsemi på grunn av benhunger, og man må også være oppmerksom på faren for kardiovaskulære komplikasjoner og hyperkalemi. I en studie med 187 nyretransplanterte pasienter som enten var paratyreoidektomert før eller etter transplantasjonen ved et av fire nederlandske akademiske sykehus i perioden 1994-2015 var det imidlertid ingen 30-dagers mortalitet. 49 % hadde hypokalsemi men bare 2,4 % trengte å ligge på overvåkingsavdeling for dette (19).
Timing av kirurgi og valg av operasjonsmetode
Det finnes ikke klare omforente retningslinjer for når det er indikasjon for paratyreoidektomi hos disse pasientene, men de fleste kan være enige i at alvorlig og vedvarende refraktær hyperparatyreoidisme med PTH-verdier >85 pmol/l som ikke kan kontrolleres tilfredsstillende med medisinsk behandling uten signifikant hyperfosfatemi eller hyperkalsemi, bør opereres dersom dette ikke er medisinsk kontraindisert.
Noe av bakgrunnen for at grensen har vært satt på dette nivået, er at lavere verdier av PTH ikke sikkert utelukker adynamisk bensykdom med lav benomsetning som kan tenkes å bli forverret etter en paratyreoidektomi. Risikoen for adynamisk bensykdom anses imidlertid for å være liten så lenge PTH er over 64 dersom pasienten samtidig har vedvarende hyperkalsemi eller hyperfosfatemi. Enkelte studier tyder på at man i tvilstilfeller kan supplere med måling av ALP for enda sikrere å utelukke dette (20).
DOPPS-studien så blant annet på dødelighet hos mer en 35 000 medikamentelt behandlede hemodialysepasienter fra en rekke forskjellige land fulgt over en 15 års periode (21). Behandlingsmålene endret seg gjennom perioden. Lavest mortalitet var det for pasientene som hadde en PTH mellom 16-32, mens mortalitet uansett årsak var litt økt i gruppen med PTH 32-48, og i gruppen med PTH >64 var det økt risiko for både kardiovaskulær død og død uansett årsak. Det var også litt økt mortalitet i gruppen som hadde PTH lavere enn 16 og man har i den medikamentelle behandlingen vært redd for å supprimere PTH for mye på grunn av risiko for adynamisk bensykdom og i de siste anbefalingene for medisinsk behandling fra Kidney Disease: Improving Global Outcomes (KDIGO) i 2017 er målet for PTH satt til en verdi på mellom 2-9 ganger øvre referansegrense for PTH for dialysepasientene (22).
Noen har vært redd for at man risikerer liknende effekter dersom PTH blir for lav etter en paratyreoidektomi og har lagt seg på et tilsvarende mål for per- og postoperativ PTH, men det finnes lite gode data å navigere etter (23). I en stor studie fra det japanske nasjonale registeret over pasienter i hemodialyse sammenliknet man data fra mer enn 4400 pasienter som var paratyreoidektomert med et tilsvarende antall ”matchede” pasienter som ikke var operert. De fant at de som var paratyreoidektomert hadde 34 % lavere mortalitetsrisiko og 41 % mindre risiko for kardiovaskulær død (24). De fant også at de som hadde en postoperativ PTH i nedre del av normalområdet hadde lavest mortalitet, men pasientene ble bare fulgt i ett år postoperativt.
Når det gjelder operasjonsmetode foreligger det to hovedalternativer: subtotal paratyreoidektomi med fjernelse av 3 ½ kjertel eller total paratyreoidektomi med autotransplantasjon av paratyreoideavev omtrent svarende til en normalt stor kjertel i musculus brachioradialis i ikke-dominant arm eller til musculus sternocleidomastoideus på halsen. De fleste sammenlikninger mellom metodene konkluderer med at begge metodene er nokså jevnbyrdige og at begge kan brukes (25). Det er kanskje litt økt fare for tilbakefall av hyperparatyreoidismen ved subtotal paratyreoidektomi og litt økt fare for hypoparatyreoidisme ved total paratyreoidektomi. Dersom pasienten kan bli kandidat for senere nyretransplantasjon er subtotal paratyreoidektomi å foretrekke, mens dersom dette er utelukket, men pasienten sannsynligvis vil gå i dialyse i mange år, vil mange anbefale total paratyreoidektomi. De fleste anbefaler at det gjøres samtidig bilateral cervical tymektomi fordi mange kan ha overtallig kjertel og 13 – 45 % kan ha intratymisk paratyreoideavev ved renal HPT (15,26).
Nyretransplantasjon er den beste behandlingen for kronisk nyresvikt i endestadiet. Transplanterte har bedre overlevelse, redusert kardiovaskulær risiko, bedret livskvalitet og de helseøkonomiske utgiftene er alt i alt lavere enn for pasienter i dialyse. Tidligere var det en etablert sannhet at når nyrefunksjonen ble normalisert etter transplantasjon, ville hyperparatyreoidismen gå tilbake hos de aller fleste i løpet av ett år, men dette har i nyere studier vist seg å ikke være riktig. 70-80 % har fortsatt forhøyet PTH ett år etter transplantasjon og ca. 40 % to år etter transplantasjon (27). Nyretransplanterte med persisterende HPT har økt risiko for nedsatt bentetthet, frakturer, kardiovaskulær sykdom og død (28,29). Det er også holdepunkter for økt risiko for tap av transplantatet, men dette kan kanskje reduseres dersom man griper inn innen 6-12 måneder etter transplantasjonen ved persisterende hyperparatyreoidisme (30). Ved alvorlig tHPT anbefales det gjerne å avvente nyretransplantasjon til pasienten er tilfredsstillende behandlet medisinsk eller kirurgisk, og ved alvorlig tHPT er kirurgi oftest å foretrekke. Høye PTH-verdier, langvarig forutgående dialysebehandling og store paratyreoideakjertler vurdert ved preoperativ ultralyd (>500 mm3) kan brukes som indikatorer på økt fare for refraktær sykdom.
Pasientgruppen med renal hyperparatyreoidisme er kompleks, der mange hensyn må tas med i vurderingene, og pasienten bør diskuteres multidisiplinært mellom nyremedisinere, endokrinologer og endokrinkirurger for å sikre den beste behandlingen i hvert enkelt tilfelle.
Konklusjon
Pasienter med sykdom i paratyreoidakjertlene er en heterogen pasientgruppe. De enkleste pasientene er ferdigbehandlet med et raskt inngrep med lav morbiditet, mens hos de vanskeligste kasusene vil man i enkelte tilfeller ikke lykkes å kurere pasienten selv etter gjentatte kirurgiske behandlinger. Reoperasjoner etter «mislykkede» inngrep er ikke uvanlig. God kunnskap hos behandlende kirurg om paratyroideakjertlenes normalanatomi og varierende beliggenhet og en optimal preoperativ billedutredning er viktige suksessfaktorer.
Referanser
1. Johansson H. The Uppsala anatomist Ivar Sandström and the parathyroid gland. Upsala Journal of Medical Sciences 2015;120: 72-77
2.Mandl F. Therapeutischer Versuch bei Ostitis fibrosa generalisata mittels Extirpation eines Epithelkörperchentumors. Wien Klin Wochenschr 1925; 50: 1343-44
3. Callender GG, Udelsman R. Surgery for Primary Hyperparathyroidism. Cancer 2014; Dec 1:3602-3616
4. Wilhelm SM, Wang TS, Ruan DT et al. The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperparathyroidism. JAMA Surg 2016; 151(10): 959-968
5. Endokrinologisk forening (Endokrinologisk veileder) https://metodebok.no/emne/xB9RLjZd
6. Vescini F, Borretta G, Chiodini I et al. Italian Guidelines for the Management of Primary Hyperparathyroidism. Endocr, Metab Immune Disord Drug Targets 2024; 24: 991-1006
7 Li Y, Simonds WF. Endocrine Neoplasms in familial syndromes of hyperparathyroidism. Endocr Relat Cancer 2016; 23: R229-R247.
8.Bilezikian JP, Khan AA, Silverberg SJ et al. Evaluation and Management of Primary Hyperparathyroidism: Summary Statement and Guidelines from the Fifth International Workshop. JBMR 2022; 37(11): 2293-2314
9. Ovcaricek PP, Giovanella L, Gasset IC et al. The EANM guidelines for parathyroid imaging. Eur J Nucl Med Mol Imaging 2021; 48: 2801-2822
10. Barczynski M, Bränström R, Dionigi G et al. Sporadic multiple parthyroid gland disease-a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbecks Arch Surg 2015; 400:887-905
11. Miccoli P, Bert P, Materazzi G et al. Minimally invasive video assisted parathyroidectomy (MIVAP). Eur J Surg Oncol 2003; 29:188-190
12 Khan ZF, Lew JI. Intraoperative Parathyroid Hormone Monitoring in the Surgical Management of Sporadic Primary Hyperparathyroidism. Endocrinol Metab 2019; 34: 327-339
13. Lau WL, Obi Y, Kalantar-Zadeh K. Parathyreoidectomy in the Management of Secondary Hyperparathyroidism. Clin J Am Soc Nephrol 2018 Jun 7; 13(6): 952-961
14. Schneider R, Slater EP, Karakas E et al. Initial Parathyroid Surgery in 606 Patients with Renal Hyperparathyroidism. World J Surg (2012); 36: 318-326
15. Dream S, Kuo LE, Kuo JH et al. The American Association of Endocrine Surgeons Guidelines for the Definitive Surgical Management of Secondary and Tertiary Renal Hyperparathyroidism. Ann Surg 2022; 276 (3): e141-e176
16. Komaba H, Kakuta T, Fukagawa M. Management of secondary hyperparathyroidism: how and why? Clin Exp Nephrol 2017; 21 (Suppl 1): S37-S45
17. Chen L, Wang K, Yu S et al. Long-term mortality after parathyroidectomy among chronic kidney disease patients with secondary hyperparathyroidism: a systematic review and meta-analysis. Ren Fail 2016; 38:1050-1058
18. Kim SS, Long J, Montez-Rath ME et al. Rates and Outcomes of Parathyroidectomy for Secondary Hyperparathyroidism in the United States. Clin J Am Soc Nephrol 2016; 11: 1260-1267
19. van der Plas WY, Dulfer RR, Koh EY et al. Safety and efficacy of subtotal or total parathyroidectomy for patients with secondary or tertiary hyperparathyroidism in four academic centers in Netherlands. Langenbecks Arch Surg 2018; 403: 999-1005
20. El-Husseini A, Wang K, Edon AA et al. Parathyroidectomy-A last resort for hyperparathyroidism in dialysis patients. Semin Dial 2017; 30: 385-389
21. Tentori F, Wang M, Bieber BA et al. Recent Changes in Therapeutic Approaches and Association with Outcomes among Patients with Secondary Hyperparathyrpoidism on Chronic Hemodialysis: The DOPPS Study. Clin J Am Soc Nephrol 2015 Jan 7; 10(1): 98-109
22. Ketteler M, Block GA, Evenepoel P et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what’s changed and why it matters. Kidney Int 2017; 92:26-36
23. Almquist M, Isaksson E, Clyne N. The treatment of renal hyperparathyroidism. Endocr Relat Cancer 2020; 27: R21-R34
24. Komaba H, Taniguchi M, Wada A et al. Parathyroidectomy and survival among Japanese hemodialysis patients with secondary hyperparathyroidism. Kidney Int 2015; 88: 350-359
25. Yuan Q, Liao Y, Zhou R et al. Subtotal parathyroidectomy versus total parathyroidectomy with autotransplantation for secondary hyperparathyroidism: an updated systematic review and meta-analysis. Langenbecks Arch Surg (2019) 404: 669-679
26. Åkerstrøm G, Malmaeus J, Bergstrøm R. Surgical anatomy of human parathyroid glands. Surgery 1984 Jan;95(1):14-21
27. Lou I, Foley D, Odorico SK et al. How well does Renal Transplantation Cure Hyperparathyroidism? Ann Surg 2015; 262 (4): 653-659
28. Cianciolo G, Tondolo F, Barbuto S et al. A roadmap to parathyroidectomy for kidney transplant candidates. Clin Kidney J 2022; 15 (8), 1459-1474
29. Pihlstrøm H, Dahle DO, Mjøen G et al. Increased Risk of All-Cause Mortality and Renal Graft Loss in Stable Renal Transplant Recipients with Hyperparathyroidism. Transplantation 2015; 99: 351-359
30. Zhao HH, Wilhelm SM. Timing of parathyroidectomy for tertiary hyperparathyroidism after kidney transplant. Surgery 2024; 176:1617-1622





