Robotassistert teknikk er godt etablert innen flere kirurgiske fagområder i Norge som urologi, thoraxkirurgi, gastrokirurgi og gynekologi. De siste årene er robotassistert teknikk også etablert innenfor endokrinkirurgien og denne bruken belyses i artikkelen.
Robotassistert minimal invasiv kirurgi hadde sin start på 1990-tallet og har utviklet seg fra den første stemmestyrte kamera-holderen til mer avanserte systemer. En av de viktigste fordelene ved dagens robotassistert teknikk er den gode bevegeligheten i de leddede instrumentene som kan roteres og vinkles nesten som et menneskelig håndledd. Dessuten gir det stabile kameraet som kirurgen selv kan styre god visualisering med 3D-syn av det kirurgiske feltet. Bevegelsesskalering og filtrering av håndtremor gir stødigere og mer nøyaktig disseksjon. Bedring av kirurgens ergonomi er en tilleggsgevinst (1). Ulemper med teknikken er økt kostnad og i noen tilfeller også økt tidsbruk på operasjonsstuen knyttet til klargjøring og docking av roboten.
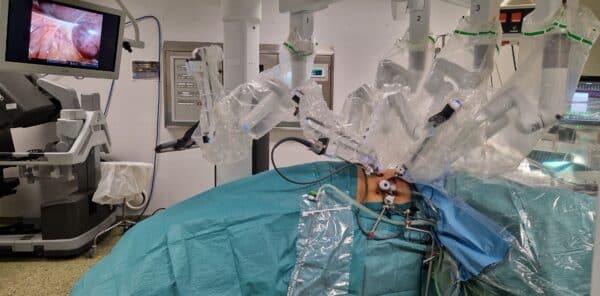
Bilde 1: Oppsett ved høyresidig robotassisterte adrenalektomi (RA). Sideleie med nyreknekk, høyre side opp. 12 mm trokar til leverhake samt hjelpeport, tre robot-trokarer. Gjengitt med tillatelse fra pasienten.
Robotassistert adrenalektomi (RA)
Den første vellykkede laparoskopiske adrenalektomien (LA) ble beskrevet av Gagner et al. i 1992 (2). I det påfølgende tiåret ble denne teknikken gradvis innført og har befestet sin stilling som gullstandard ved kirurgi på binyre ved benign og i mange tilfeller også ved malign sykdom. LA kan utføres både transabdominalt og retroperitoneoskopisk, oftest valgt etter kirurgens foretrukne metode. I Norge var miljøet ved Intervensjonssenteret ved Oslo universitetssykehus med Bjørn Edwin i spissen først ute med denne prosedyren. Som mange andre laparoskopiske inngrep egner binyrekirurgi seg godt for robotassistert kirurgi. Første robotassisterte adrenalektomi (RA) ble utført av Piazza i 1999 (3). Første robotassisterte partielle adrenalektomi ble utført i 2006 på en pasient med bilaterale feokromocytomer ved von Hippel-Lindaus syndrom (4). I Norge ble RA først tilbudt ved Radiumhospitalet på urologiske pasienter i 2004. Metoden ble innført på Haukeland universitetssykehus i 2022 og har vært standard på Universitetssykehuset Nord-Norge siden januar 2024.
Robotassistert teknikk ved binyrekirurgi har flere fordeler i forhold til vanlig laparoskopisk teknikk. De leddede instrumentene kan roteres og vinkles og gjør det lettere å komme til med fin disseksjon rundt svulster i binyrene og langs med omgivende strukturer, for eksempel ved fridisseksjon av binyrevenen langs vena cava på høyre side. Kirurgstyrt, stabilt kamera med godt 3D-syn gir god oversikt og nøyaktighet ved disseksjonen og kan være en fordel, spesielt ved barksparende kirurgi. Dette er for eksempel aktuelt ved kirurgi av feokromocytom ved påvist genfeil ved von Hippel-Lindau og MEN 2A og B. Av ulemper kan relativ lang læringskurve nevnes. Gjennomgang av litteraturen har antydet cirka 20 inngrep før resultatene ved RA er sammenlignbare med LA (5). I tillegg må man påregne lenger operasjonstid på grunn av ekstra tid for docking av roboten. Dette er vist i komparative studier og bekreftet i metaanalyser (6,7). Økte kostnader er ulempe ved RA som ved all robotassistert kirurgi.
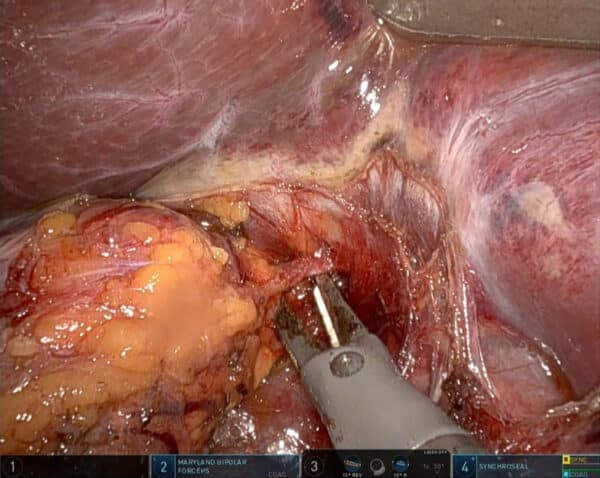
Bilde 2: Bilde fra robot-konsoll tatt under høyresidig RA. Leveren er løftet frem med hake. Binyre til venstre i bildet, instrumentet under binyrevenen som på høyre side går horisontalt inn i vena cava.
RA har tilsvarende resultater som LA når det kommer til intra- og postoperative komplikasjoner, samt mortalitet ifølge en metaanalyse fra 2017 (6), mens data fra Eurocrine-registeret antyder lavere komplikasjonsrate hos pasienter som er operert med RA sammenlignet med LA (8). Både metaanalyser og data fra Eurocrine-registeret har vist at pasienter som er operert med RA har kortere sykehusinnleggelse enn pasienter som er operert med LA (6,7,8,9). Gjennomsnittlig liggetid var mellom 0,35 og 1 dag kortere etter RA enn etter LA.
På Haukeland universitetssykehus ble RA innført i oktober 2022 og ved utgangen av mars 2025 er det utført 70 robotassisterte inngrep. Som forberedelse til oppstarten hospiterte to kirurger i Lund i Sverige, der RA har vært standard siden år 2000. Kirurgene fikk robotsertifisering ved Intuitive og brukte mye tid på å trene i simulatoren. Teamet rundt kirurgene på operasjonsstuen hadde jobbet med robotassisterte inngrep på gastrokirurgisk avdeling i flere år og var i så måte drillet i det praktiske rundt selve roboten. Til støtte og god hjelp var Bjørn Brennhovd fra Oslo universitetssykehus til stede på operasjonsstuen på de to første inngrepene.
Erfaringen med RA fra Haukeland universitetssykehus har vært positiv. Kirurgene opplevde det uvant i starten å ikke ha den taktile feedback ved disseksjon og håndtering av vevet, men dette ble fort en vanesak. Å finne riktig portplassering for å unngå at portene/instrumentene kom i konflikt under inngrepet var en annen utfordring som ble mindre med erfaring. Det har vært få komplikasjoner og konverteringer og vi opplever at vi planlegger og fullfører laparoskopisk (robotassistert) kirurgi på større benigne svulster enn tidligere.
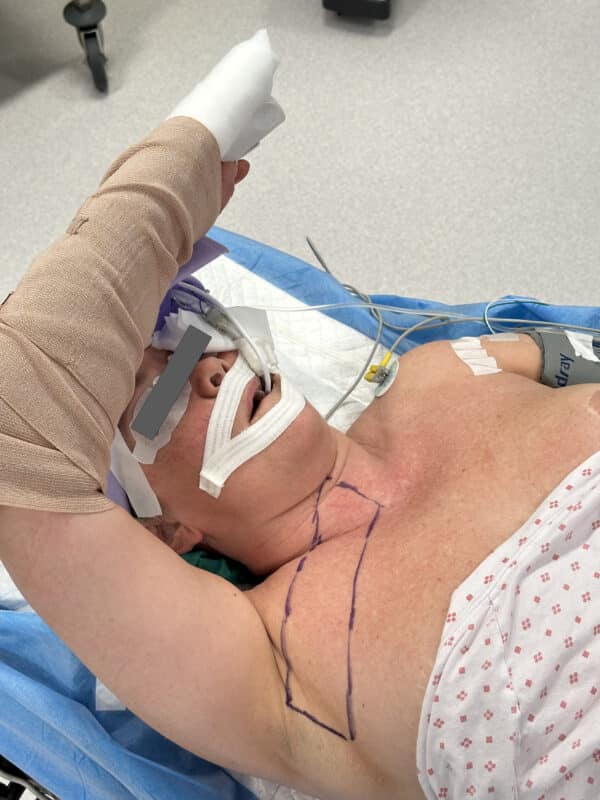
Bilde 3: Ved transaksillær robotassistert tyreoidektomi opereres pasienten gjennom en subkutan tunell (opptegning) mens huden løftes av en retraktor. Bildet er trykket med pasientens samtykke.
Robotassistert transaksillær tyreoidektomi (RATT)
Tyreoidektomi gjennom den tradisjonelle cervikotomien (kragesnitt) er forbundet med lite lokale plager og har for de fleste et akseptabelt kosmetisk resultat. Imidlertid vil et synlig arr så nært ansiktet for noen være sjenerende og en daglig påminnelse om gjennomgått sykdom. Ønsket om å redusere/unngå arr på halsen har vært hoveddrivkraften i utviklingen av alternative kirurgiske teknikker for endokrin halskirurgi de siste 30 årene. I tillegg har man håpet at videoassisterte teknikker kunne redusere noen av de vanlige komplikasjonene og bivirkningene av kirurgien, slik som stemmeforandringer, svelgeproblemer, stemmebåndslammelse og hypoparatyreoidisme.
De første alternativene til tradisjonell tyreoidektomi oppstod på 90-tallet i form av videoassistert minimal invasiv kirurgi (10,11). Konseptet minimal invasiv videoassistert tyreoidektomi (MIVAT) innebar at man kunne klare seg med en kort incisjon som ga tilstrekkelig plass for både vanlige håndholdte instrumenter og laparoskopikameraet (12). Det neste tiåret ble det utviklet videoassisterte teknikker, der tilgangen til tyreoidea ble flyttet vekk fra halsen. Inngrepet ble utført med endoskopiske instrumenter gjennom subkutane tuneller til halsen slik at alle arr i huden kunne plasseres på mindre synlige steder, enten fra axille/bryst, postaurikulært (facelift) eller fra underleppa (13,14). De ulike tilgangene har spesifikke fordeler og ulemper, for eksempel risiko for nerveskader i forbindelse med etablering av tilgangen. Bruk av gass er forlatt til fordel for haker eller tråder som holder huden oppe for å lage plass, da CO2 gir subkutant emfysem og risiko for alvorlige komplikasjoner som gassemboli.
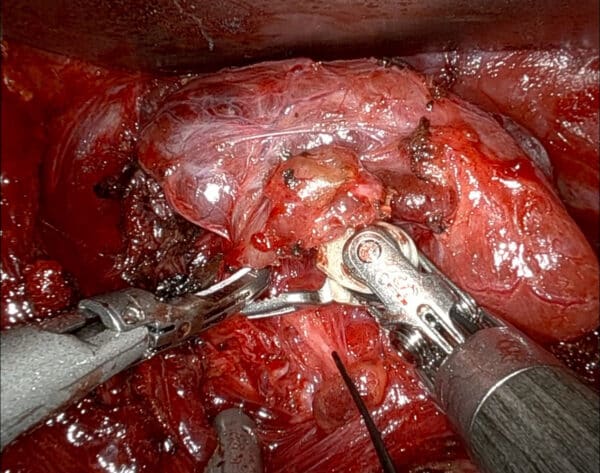
Bilde 4: Bilde fra robot-konsoll under høyresidig transaksillær robotassistert hemityreoidektomi. Nervestimulatoren ses fra nedre høyre del av bildet og peker på nervus laryngeus recurrens. Bak nervestimulatoren ses også paratyreoidea.
I Norge har robotassistert transaksillær tyreoidektomi (RATT) vært tilbudt ved Universitetssykehuset Tromsø til utvalgte pasienter siden 2022. Siden metoden var ny i Norge, ble det først gjort metodevurdering (minimetodevurdering.no). Opplæringen skjedde i samarbeid med Gabriele Materatzzi fra Pisa, Italia, der de har en av de største europeiske erfaringene med teknikken siden 2012. RATT har hatt en sakte utbredelse fra opprinnelsen i Asia til Europa i løpet av de siste 10-15 årene, men finnes godt etablert i enkelte europeiske land. RATT har gjennomgått en utvikling siden år 2000, der man har forsøkt innføring av instrumenter via en eller begge aksiller, eventuelt med hjelpeporter i areolakanten på brystene (15). På Universitetssykehuset Nord-Norge gjøres nå operasjonen med kun én incisjon i forkant av aksillen. Tilgangen til halsen går gjennom en subkutan tunell, der huden holdes oppe av en spesialtilpasset retraktor. Selve tyreoidektomien utføres med robot-assistert karforsegler og disseksjonsinstrument. Nervemonitorering brukes som ved åpen kirurgi.
Størrelse på tumor er den største begrensningen ved metoden. I erfarne hender kan man operere opp mot 6 cm store tyreoideatumores, men når størrelsen overstiger 4 cm blir det merkbart trange arbeidsforhold. Det er mulig å gjøre lymfeknutedisseksjon med RATT, men det tilbys foreløpig ikke RATT til pasienter med lymfeknutemetastaser ved Universitetssykehuset Nord-Norge. Andre relative kontraindikasjoner kan være tidligere kirurgi i området, tyreoiditt og høy BMI. Oppsummert egner metoden seg for pasienter der kosmetisk resultat betyr mye, som er normalvektige og har en relativt liten tumor.
Studier fra sentra som har stor erfaring viser at risiko for rekurrensparese og hypoparatyreoidisme er sammenlignbar med åpen teknikk, og at alvorlige komplikasjoner forekommer i svært liten grad (16,17). Det finnes enkeltstudier som viser forbedret pasienttilfredshet og stemmekvalitet ved RATT sammenlignet med åpen kirurgi (18,19). Erfaringen med de første cirka 20 RATT i Norge har vist at metoden er mulig å etablere uten at vi hittil har hatt alvorlige hendelser eller uventede komplikasjoner. Pasientene blir utskrevet første postoperative dag som ved vanlig åpen operasjon.
Referanser
- C Pérez-Salazar MJ et al. Comparative Study of Ergonomics in Conventional and Robotic-Assisted Laparoscopic Surgery. Sensors 2024 Jun 14;24(12):3840.
- Gagner M, Lacroix A, Bolté E. Laparoscopic adrenalectomy in Cushing’s syndrome and pheochromocytoma. N Engl J Med. 1992;327(14):1033
- Piazza L, Caragliano P, Scardilli M, Laparoscopic robot-assisted right adrenalectomy and left ovariectomy (case reports) Chir Ital. 1999;51(6):465–466.
- Jamii St Julien et al, Robot-assisted cortical-sparing adrenalectomy in a patient with Von Hippel-Lindau disease and bilateral pheochromocytomas separated by 9 years, J Laparoendosc Adv Surg Tech A 2006 Oct;16(5):473-7.
- Morris LF, Perrier ND. Advances in robotic adrenalectomy. Curr Opin Oncol. 2012;24(1):1–6
- Economopoulos KP, Mylonas KS, Stamou AA, Laparoscopic versus robotic adrenalectomy: a comprehensive meta-analysis. Int J Surg. 2017;38:95–104
- Tang K, Li H, Xia D, Robot-assisted versus laparoscopic adrenalectomy: a systematic review and meta-analysis. J Laparoendosc Adv Surg Tech A. 2015;25(3):187–195
- Safa Vatansever et al, Robot-assisted versus conventional laparoscopic adrenalectomy: Results from the EUROCRINE Surgical Registry, Surgery 2022 May;171(5):1224-1230
- Lairmore TC, Folek J, Govednik CM, Improving minimally invasive adrenalectomy: selection of optimal approach and comparison of outcomes. World J Surg. 2016;40(7):1625–1631.
- Lirici MM, Hüscher CSG, Chiodini S, Endoscopic right thyroid lobectomy. Surg Endosc. 1997 Aug;11(8):877–877.
- Gagner M. Endoscopic subtotal parathyroidectomy in patients with primary hyperparathyroidism. J Br Surg. 1996 Jun 1;83(6):875–875.
- Miccoli P, Berti P, Conte M, Minimally invasive surgery for thyroid small nodules: Preliminary report. J Endocrinol Invest. 1999 Dec;22(11):849–51.
- Lee MC, Ahn J, Choi IJ, Comparative Study of Gasless Transaxillary, Bilateral Axillo-Breast, Unilateral Axillo-Breast With Carbon Dioxide Insufflation, Retroauricular, and Transoral Vestibular Endoscopic Thyroidectomy Approaches at a Single Institution: A Retrospective Analysis and Lessons Learned. Clin Exp Otorhinolaryngol. 2022 Aug 31;15(3):283–91.
- Chang EHE, Kim HY, Koh YW, Overview of robotic thyroidectomy. Gland Surg. 2017 Jun;6(3):218–28.
- Ikeda Y, Takami H, Sasaki Y, Endoscopic neck surgery by the axillary approach1. J Am Coll Surg. 2000 Sep;191(3):336–40.
- Kim MJ, Chung WY. Yonsei, Experience of 5000 Gasless Transaxillary Robotic Thyroidectomies: Reply. World J Surg. 2018 Jul;42(7):2281–2.
- Papini P, De Palma A, Ginesini M, Robot-assisted transaxillary surgery for thyroid cancer: Oncologic and surgical outcomes in long term follow-up. Int J Med Robot. 2024 Feb;20(1):e2563.
- Matteucci V, Bai D, Fregoli L, The effect of robot-assisted transaxillary thyroidectomy (RATT) on body image is better than the conventional approach with cervicotomy: a preliminary report. Updat Surg. 2021 Jun;73(3):1169–75.
- Song CM, Yun BR, Ji YB, Long-Term Voice Outcomes After Robotic Thyroidectomy. World J Surg. 2016 Jan;40(1):110–6.





